
| A. | 能和碳酸钠溶液反应 | B. | 能和二氧化碳反应 | ||
| C. | 能和铁反应 | D. | 能和氢氧化铜反应 |
分析 稀硫酸能和碳酸钠反应生成硫酸钠、水和二氧化碳;
稀硫酸不能和二氧化碳反应;
稀硫酸能和铁反应生成硫酸亚铁和氢气;
稀硫酸能和氢氧化铜反应生成硫酸铜和水.
解答 解:A、稀硫酸能和碳酸钠反应生成硫酸钠、水和二氧化碳,需要通过化学变化表现出来,属于硫酸的化学性质;
B、硫酸不能和二氧化碳反应,因此不属于硫酸的化学性质;
C、稀硫酸能和铁反应生成硫酸亚铁和氢气,需要通过化学变化表现出来,属于硫酸的化学性质;
D、稀硫酸能和氢氧化铜反应生成硫酸铜和水,需要通过化学变化表现出来,属于硫酸的化学性质.
故选:B.
点评 物质的化学性质需要通过化学变化表现出来,而二氧化碳不能和硫酸反应,因此B选项不属于硫酸的化学性质.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
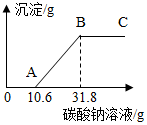 在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:
在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某补钙剂说明书的部分信息如图所示,现将20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应.反应后称得剩余物的质量为55.6g.
某补钙剂说明书的部分信息如图所示,现将20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应.反应后称得剩余物的质量为55.6g.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 某黑色固体含有MnO2、Na2SO4、KCl、C(少量)等物质.化学小组欲通过以下流程,分离并回收部分物质.回答相关问题;
某黑色固体含有MnO2、Na2SO4、KCl、C(少量)等物质.化学小组欲通过以下流程,分离并回收部分物质.回答相关问题;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
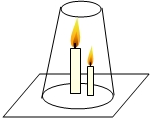
| A. | 低的蜡烛先灭,因为二氧化碳的密度比空气的密度大 | |
| B. | 高的蜡烛先灭,气体受热膨胀,二氧化碳会上升,聚在玻璃杯的上方 | |
| C. | 该实验说明人从着火的房间逃离时,必须呈站立姿势跑出 | |
| D. | 两只蜡烛同时熄灭,因为玻璃杯中充满了二氧化碳气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
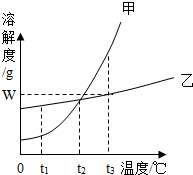 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com