

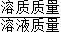 ×100%即可求得所得溶液的质量分数.
×100%即可求得所得溶液的质量分数.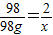
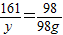
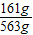 ×100%≈28.6%.
×100%≈28.6%.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:初中化学 来源: 题型:
 某药品瓶上的标签如下:回答:
某药品瓶上的标签如下:回答:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
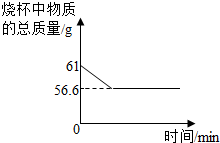 (2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(2012?无锡二模)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管,滴加 氯化钡溶液(或稀硫酸) 氯化钡溶液(或稀硫酸) . |
有白色沉淀(或有气泡) 有白色沉淀(或有气泡) |
该溶液是碳酸钠溶液.有关反应的化学方程式为: Na2CO3+BaCl2═BaCO3↓+2NaCl Na2CO3+BaCl2═BaCO3↓+2NaCl . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣.
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣.| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:
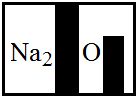 某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示),他们对此产生了兴趣.
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示),他们对此产生了兴趣.| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com