
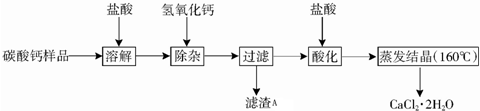
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 10.8 |
分析 根据物质的性质、实验操作的方法以及所使用的仪器进行分析解答,根据反应的化学方程式计算即可.
解答 解:(1)在实验室进行溶解时玻璃棒起到了搅拌、加速溶解的作用,过滤时用到的玻璃仪器有烧杯、玻璃棒、漏斗,故填:搅拌,加速溶解;漏斗.
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH要使Al3+、Fe3+全部转化为沉淀,根据表格提供的信息可以看出,需要控制溶液的pH值X的范围是5.2~7.8;得到的滤渣A中含有氢氧化铁和氢氧化铝,故填:5.2~7.8;Fe(OH)3、Al(OH)3.
(3)酸化时加盐酸的主要目的为了将氢氧化钙转化为氯化钙,故填:将氢氧化钙转化为氯化钙.
(4)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则设CaCO3最大质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1Kg
则$\frac{100}{111}=\frac{x}{11.1Kg}$
解得x=10Kg
$\frac{10Kg}{12.5Kg}×100%$=80%
答:样品中碳酸钙的质量分数最大为80%.
点评 此题主要考查实验的基本操作、实验仪器的选择、实验误差分析.注意离子的检验方法和常见仪器的使用,样品纯度的分析要注意溶液中可能发生的反应,注意有效数字问题.


科目:初中化学 来源: 题型:选择题
| A. | 用一氧化碳冶炼金属:CO+O2$\frac{\underline{\;燃烧\;}}{\;}$CO2 | |
| B. | 用适量盐酸清除铁锈:Fe2O3+6HCl═2FeCl2+3H2O | |
| C. | 用红磷燃烧测定空气中氧气的含量:4P+5O2↑$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | |
| D. | 高温燃烧石灰石制取生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在空气中打开浓盐酸的瓶盖冒白雾 | |
| B. | 向滴有酚酞溶液的蒸馏水中加入氢氧化铜,溶液显红色 | |
| C. | 久置于空气中的熟石灰,加入稀盐酸会有气体产生 | |
| D. | 铁丝在氧气中燃烧,火星四射,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
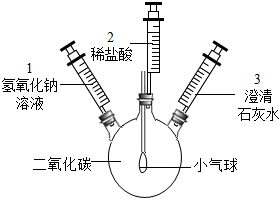 许多化学反应都伴随着明显的现象.但也有一些观察不到明显现象.某化学小组的同学探究二氧化碳与氢氧化钠反应的现象,设计了如下实验方案,请根据要求回答下列问题:
许多化学反应都伴随着明显的现象.但也有一些观察不到明显现象.某化学小组的同学探究二氧化碳与氢氧化钠反应的现象,设计了如下实验方案,请根据要求回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铜在空气中受热:Cu+O2=2CuO | |
| B. | 用石灰水刷墙,墙壁逐渐变白变硬:Ca(OH)2+CO2=CaCO3↓+H2O | |
| C. | 正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3 | |
| D. | 除去铜粉中少量的铁粉:3Fe+6HCl=2FeCl3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com