
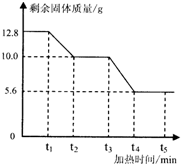
 草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如图所示.请回答下列问题:
草酸钙(化学式为CaC2O4,相对分子质量为128)是一种难溶于水的白色固体,受热能分解.小红同学为了探究其在加热条件下发生的变化,进行如下实验:取12.8g草酸钙固体在不断加热的条件下测得剩余固体的质量随时间变化如图所示.请回答下列问题:| 同学 | 实验操作 | 实验现象 | 结论 |
| 小强 | 取少量固体放入烧杯中,加适量水并搅拌 | 烧杯发热 | 剩余固体中一定含有CaO(或氧化钙). 一定不含有CaC2O4. |
| 小明 | 另取少量固体放入试管中,加足量稀盐酸 | 有气体产生 | 剩余固体中一定含有CaCO3(或碳酸钙). |
分析 (1)在t1~t2时间段内,加热草酸钙时产生了极易与血红蛋白结合的有毒气体,此气体是一氧化碳,一种白色固体与大理石的主要成分相同,应是碳酸钙,因此,在加热草酸钙时,草酸钙易分解为碳酸钙和一氧化碳;
(2)当草酸钙完全分解而又未达到碳酸钙分解的温度时,剩余固体的质量不变,这就是在t2~t3时间段内剩余固体质量不变的原因;
(3)当对上述固体继续加热时,生成的碳酸钙又分解为氧化钙和二氧化碳,由于放出二氧化碳又会使剩余固体的质量减少;
(4)【设计方案并实验】向清液中加入紫色石蕊试液,试液变成蓝色,溶液显碱性,溶液显碱性的原因是由于剩余固体中生成的氧化钙和水反应生成氢氧化钙,因为溶液显碱性,一定没有草酸钙;向剩余固体中加入稀盐酸,有气体产生,可推出剩余固体中一定有碳酸钙.综上所述,剩余固体中有氧化钙、碳酸钙.
【交流与讨论】由于碳酸钙未完全分解,小强和小明加热的草酸钙的剩余物与t3~t4时间段的物质成分相同.
解答 解:(1)在 t1~t2时问段内:产生了一种极易与血红蛋白结合的有毒气体,该气体是一氧化碳,化学式是CO;产生的一种白色固体,它与大理石的主要成分相同,这种那白色固体是碳酸钙.发生反应的方程式是:CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑
(2)碳酸钙分解的温度要高于草酸钙分解的温度,当草酸钙完全分解,而温度又未达到碳酸钙的分解温度时,固体的质量不变,所以,t2~t3时间段内固体质量不变.
(3)在t3~t4时间段内,碳酸钙发生了分解,方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
(4)【设计方案并实验】向清液中加入紫色石蕊试液,试液变成蓝色,溶液显碱性,溶液显碱性的原因是由于剩余固体中的氧化钙和水反应生成氢氧化钙,因为溶液显碱性,一定没有草酸钙;通过向剩余固体中加入稀盐酸,有气体产生,可推出剩余固体中一定有碳酸钙.
【交流与讨论】综上所述,剩余固体中由氧化钙、碳酸钙,与t3~t4时间段的物质成分相同.
故答为:(1)CO,CaC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CaCO3+CO↑;
(2)草酸钙已完全分解,但尚未达到碳酸钙的分解温度;
(3)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(4)【设计方案并实验】
| 同学 | 实验操作 | 实验现象 | 结论 |
| 小强 | CaO(或氧化钙) | ||
| 小明 | CaCO3(或碳酸钙) CaCO3+2HCl=CaCl2+CO2↑+H2O, |
点评 本题通过实验探究了草酸钙的性质和变化规律.草酸钙受热易分解生成了碳酸钙和一氧化碳,因为放出了一氧化碳,剩余固体的质量减少.当草酸钙完全分解后继续加热一段时间后,剩余固体的质量又减少,这时一定要联想我们已学过的知识碳酸钙高温也能分解为氧化钙和放出二氧化碳,也会造成剩余固体质量的减少,这是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 检验NaCl中是否含有Na2CO3,(加水溶解) | |
| B. | 测量洗衣粉的酸碱度 (用pH试纸测定其pH) | |
| C. | 区别KCl和NH4Cl两种固态化肥 (分别加入Ca(OH)2固体,研磨) | |
| D. | 除去铜粉中的铁粉 (加入足量的CuCl2溶液后过滤) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大气污染物包括NO2、SO2、CO2等气体 | |
| B. | 工厂加高烟囱可以减少污染气体的排放 | |
| C. | 空气质量级别值越大空气质量越好 | |
| D. | 室外戴N95专业口罩(滤孔径0.1微米左右)减少PM2.5的吸入 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 操 作 或 现 象 | 分 子 的 特 性 |
| A | 将气体压缩储存在钢瓶中 | 分子间有间隔 |
| B | 在花园中可闻到花的香味 | 分子是运动的 |
| C | 酒精和水各100ml混合在一起,体积小于200ml | 分子是有质量的 |
| D | 加热氧化汞可得到金属汞和氧气 | 分子是可以再分的 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在同一化合物中,金属元素显正价,则非金属元素一定显负价 | |
| B. | 金属和酸反应能生成气体,和酸反应生成气体的物质一定是金属 | |
| C. | 点燃不纯的一氧化碳易发生爆炸,则点燃一氧化碳前一定要验纯 | |
| D. | 置换反应生成单质和化合物,则有单质和化合物生成的反应一定是置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com