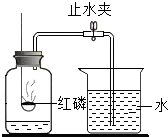
二氧化碳是一种奇妙的气体,某校化学兴趣小组在老师指导下,进行了《实验室二氧化碳的制取及其性质》实验,请你帮助回答下列问题.
(1)在大试管中加入5粒石灰石、倾倒约试管体积三分之一的稀盐酸(1:1),取一支中试管用排空气法收集CO
2,验满,另一支中试管用排水法收集CO
2,集满.发现
先收集满.该操作过程中合理的排列顺序是(选填序号)
.
①检验装置的气密性 ②待有连续稳定气泡再排水集气
③将水槽中待收集气体的小试管注满水 ④旋紧连有导管的单孔胶塞
⑤向大试管内5粒石灰石再倒入三分之一的盐酸(1:1)
(2)实验时用大试管与带导管的单孔胶塞制取二氧化碳气体,
说明该装置气密性良好,制取该气体发生的化学方程式是
.此装置还可以制取
气体,制气反应的化学方程式是
,从反应物的状态和反应条件说明为什么可用制二氧化碳的装置制该气体
.
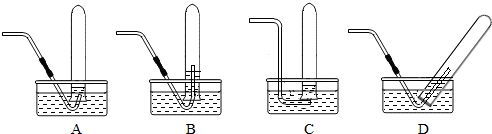
(3)用试管进行排水法收集二氧化碳气体时,主要出现了如图示所示的4种操作,其中合理的是(此小题为不定项选择填空,多选,错选不给分)
.
(4)小刚在做完实验后,准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na
2CO
3溶液,他决定利用该废液,测定Na
2CO
3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na
2CO
3溶液,加入Na
2CO
3溶液的质量与生成沉淀质量的关系如图所示.
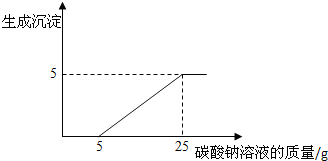
分析1:在加入Na
2CO
3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl
2外,还含有的微粒是
;若不用指示剂,向该“混合液”中加入
可变成主要含氯化钙的中性溶液.
分析2:所滴加的Na
2CO
3溶液中溶质的质量分数是
.(计算结果精确到0.1%)

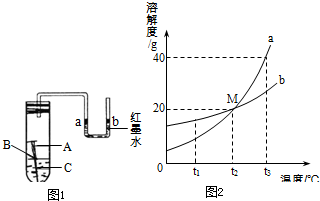 (1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:
(1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:

 天天练口算系列答案
天天练口算系列答案

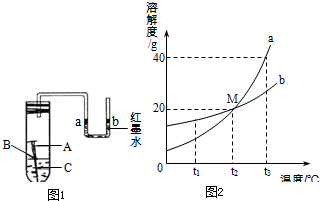 (1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:
(1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到: