
科目:初中化学 来源: 题型:解答题
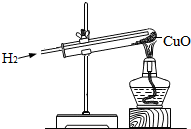 右图所示为氢气还原氧化铜的实验装置:
右图所示为氢气还原氧化铜的实验装置:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 含硫物质 | K2SO4 | MnSO4 | CaSO4 | CaSO3 | FeSO4 | Fe2(SO4)3 |
| 溶解性 | 溶 | 溶 | 微溶 | 难溶 | 溶 | 溶 |
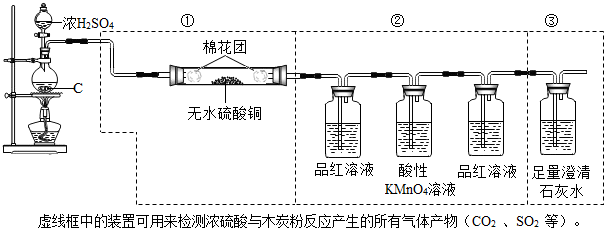
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
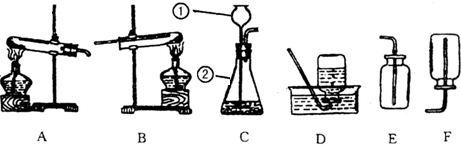
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氦、氮、氧 | B. | 氧、氮、氦 | C. | 氮、氧、氦 | D. | 氧、氦、氮 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验主要现象 | 实验结论 |
| 1向a试管中加入少量NaCl晶体 | 产生气泡速度不变 | 钠离子对反应速度无影响 |
| 2向b试管中加入少量硫酸钠晶体 | 产生气泡速度不变 | 猜想①不成立 |
| 3向c试管中加入少量Cu粉 | 产生气泡速度明显加快 | 猜想④成立 |
| 4向d试管中加入少量CuSO4粉末 | 产生气泡速度,与第3步c试管的速度几乎一样快 | 猜想③成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com