
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解


| 加热 |
| 加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. |
pH>7 | CaCl2、Ca(OH)2 CaCl2、Ca(OH)2 |
pH≤7 pH≤7 |
CaCl2 |
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Ba2+ | 溶 | 溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 微溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:
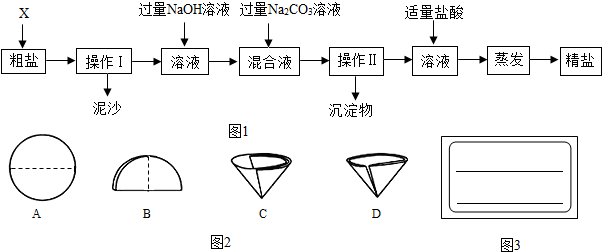
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com