
| A. | 等质量的CO和CO2,CO和CO2中氧元素的质量比为11:14 | |
| B. | 等质量的Al和Mg分别与足量稀硫酸充分反应,生成H2的质量相等 | |
| C. | 等质量的NaHCO3和MgCO3分别与足量稀盐酸充分反应,生成CO2的质量不相等 | |
| D. | 等质量的质量分数均为4%氢氧化钠溶液与稀盐酸充分反应,所得溶液显中性 |
分析 A、根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答;
B、根据各元素的相对原子质量和它们与稀硫酸反应的化学方程式,计算出1g金属分别与足量稀硫酸反应生成氢气的质量,再进行比较即可;
C、根据碳元素的质量守恒来完成解答,结合这四种物质与盐酸反应的化学方程式可以知道二氧化碳中的碳元素和碳酸盐中的碳元素的质量相等;设碳酸盐的质量为m,相对分子质量为M,则可以判断碳酸盐中碳元素的质量为:m×$\frac{12}{M}$,根据该计算式可以知道,当碳酸盐的相对分子质量越大,则生成的二氧化碳的质量就越小;
D、根据等质量、等质量分数的盐酸和氢氧化钠两种溶液充分混合后,盐酸与氢氧化钠溶液中所含溶质的质量相等和化学方程式进行解答
解答 解:A、氧元素的质量比为CO:CO2=$\frac{16}{28}$:$\frac{16×2}{44}$=11;14,故说法正确;
B、Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成$\frac{1}{12}$g氢气,Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成$\frac{1}{9}$g氢气,故B说法错误;
C、分析所给碳酸盐可以知道:M(NaHCO3)=84,M(MgCO3)=84,所以可以判断生成二氧化碳气体的质量相等,故C说法错误;
D、反应中消耗盐酸酸与氢氧化钠的质量比关系如下:
HCl+NaOH═NaCl+H2O
36.5 40
可知,36.5份质量的盐酸与40份质量的氢氧化钠恰好完全反应,则等质量、等质量分数的盐酸和火碱两种溶液充分混合后,稀盐酸有剩余,溶液显酸性,故D错误;
故选:A.
点评 本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:解答题
实验操作 | 实验结果 |
| 取100ml水,加入25g硝酸钾,搅拌 | 全部溶解,得溶液① |
| 再加10g硝酸钾,搅拌,还有3.4g固体不溶 | 得溶液② |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
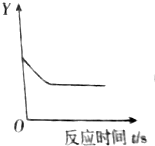
| A. | 氯酸钾加热分解中氧元素质量的变化 | |
| B. | 铁片放在硫酸铜溶液中溶液的质量变化 | |
| C. | 木炭粉与氧化铜在高温下剩余固体的质量变化 | |
| D. | 氢氧化钠溶液与硫酸铜溶液混合后溶液的质量变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 等于$\frac{a}{b}$×100% | B. | 等于$\frac{a}{a+b}$×100% | C. | 不大于$\frac{a}{a+b}$×100% | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
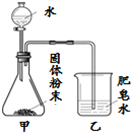 “食品蒸汽加热器”常用于野外加热食物.加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热.实验小组针对放热过程中的反应原理展开探究.
“食品蒸汽加热器”常用于野外加热食物.加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热.实验小组针对放热过程中的反应原理展开探究.| 实验序号 | A | B | C | D | E | F |
| 固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
| 乙中现象 | 少量肥皂泡,难以点燃 | ① | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡, 点燃有爆鸣声 |
| 混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
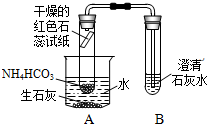 小明的邻居张大爷是种植蔬菜专业户,去年购买的化肥,由于外包装上的字迹看不清,只记得是硫酸钾、碳酸氢铵、氯化铵中的一种,张大爷正为此烦恼.
小明的邻居张大爷是种植蔬菜专业户,去年购买的化肥,由于外包装上的字迹看不清,只记得是硫酸钾、碳酸氢铵、氯化铵中的一种,张大爷正为此烦恼.| 实验步骤 | 实验现象 | 反应的化学方程式 |
| 1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | AG的值越大,溶液的pH越小 | B. | 若某溶液的AG=0,则该溶液的pH=0 | ||
| C. | 25℃时,纯水的AG=0,pH=7 | D. | 25℃时,pH>7的溶液中AG<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com