
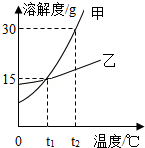
 作图法是对实验数据处理和分析的一种常用方法.甲、乙两种固体物质的溶解度曲线如图所示,根据图示回答下列问题:
作图法是对实验数据处理和分析的一种常用方法.甲、乙两种固体物质的溶解度曲线如图所示,根据图示回答下列问题:分析 根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;在t1时,甲的溶解度等于乙的溶解度;t2℃时,50g甲物质溶于100g水中所形成饱和溶液,因为在该温度下,甲的溶解度是30g;该溶液的溶质质量分数=$\frac{30g}{130g}×100%$≈23.1%;若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是降温结晶,因为甲的溶解度随温度的升高变化比乙大;将t2℃时甲物质的饱和溶液降温至t1℃,溶液中溶质的质量分数会减小,因为溶液中有固体析出.
解答 解:(1)由溶解度曲线可知:在t1时,甲的溶解度等于乙的溶解度;故答案为:=;
(2)t2℃时,50g甲物质溶于100g水中所形成饱和溶液,因为在该温度下,甲的溶解度是30g;该溶液的溶质质量分数=$\frac{30g}{130g}×100%$≈23.1%;故答案为:饱和;23.1%;
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是降温结晶,因为甲的溶解度随温度的升高变化比乙大;故答案为:降温结晶;
(4)将t2℃时甲物质的饱和溶液降温至t1℃,溶液中溶质的质量分数会减小,因为溶液中有固体析出;故答案为:减小;
点评 本考点考查了溶解度曲线及其应用和实验数据的处理问题,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.


科目:初中化学 来源: 题型:选择题
| A. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | B. | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| Al | Fe | Cu | ||
| 现象 | 开始时 | 几乎无气泡产生 | 产生气泡速率慢 | 无气泡产生 |
| 一段时间后 | 产生气泡速率快 | 产生气泡速率慢 | 无气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁制品在潮湿空气中易生锈 | |
| B. | 常温下所有金属都是银白色的固体 | |
| C. | 铁和稀硫酸反应生成硫酸亚铁和氢气 | |
| D. | 合金的许多性能和组成它们的纯金属不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
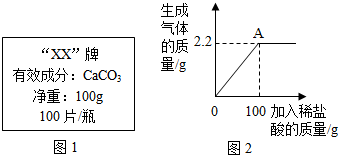 某品牌补钙剂说明书的部分信息如图1所示.化学兴趣小组准备测定该补钙剂中有效成分的质量分数,取10片钙片加入稀盐酸至不再产生气泡为止(其他成分既不溶于水,也不与盐酸反应).并绘制了加入稀盐酸的质量与放出气体质量的关系图如图2,则回答:
某品牌补钙剂说明书的部分信息如图1所示.化学兴趣小组准备测定该补钙剂中有效成分的质量分数,取10片钙片加入稀盐酸至不再产生气泡为止(其他成分既不溶于水,也不与盐酸反应).并绘制了加入稀盐酸的质量与放出气体质量的关系图如图2,则回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com