


科目:初中化学 来源: 题型:阅读理解
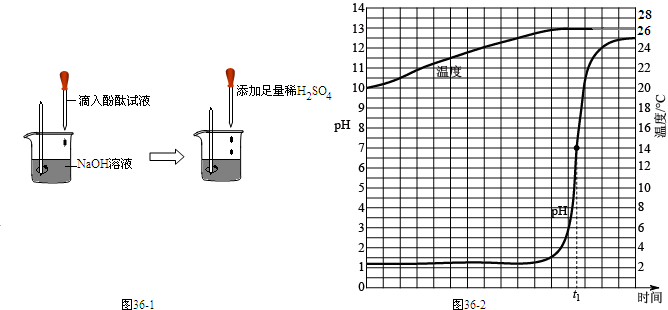
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
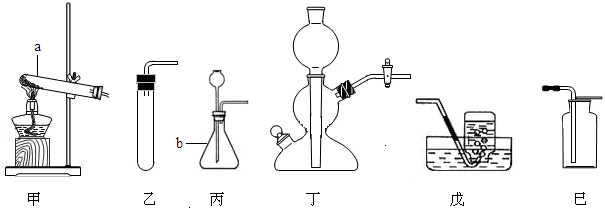
| 比较项目 | 向上排空气法 | 排水集气法 | 结论 |
| 方法可行性 | O2的密度比空气 |
O2难溶于水且不与水反应 | 两种方法均可行 |
| 收集的过程 | “验满”分析:即便用带火星的木条移近集气瓶口,木条复燃也难以证明空气被排尽,因气体无色,集满与否较难确定. | 集满O2的现象是 |
排水法收集O2更易于观察何时集满 |
| 收集O2的纯度 | 分别用排水法和向上排空气法收集两瓶氧气(A和B),放入两支相同的蜡烛.可观察到B瓶内的蜡烛熄灭较早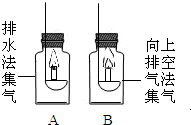 |
结论 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
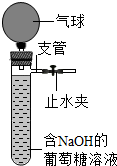 (2013?下城区二模)实验老师发现,他一周前配好的无色透明的葡萄糖溶液变成了黄色,他对产生此现象的原因十分好奇,进行了如下实验探究.
(2013?下城区二模)实验老师发现,他一周前配好的无色透明的葡萄糖溶液变成了黄色,他对产生此现象的原因十分好奇,进行了如下实验探究.| 编号 | 所加的物质 | 温度 | pH | 变色情况 | |
| A | 80mL蒸馏水 | 20g葡萄糖 | 22℃ | 7 | 28天后呈极浅黄色 |
| B | 80mL自来水 | 20g葡萄糖 | 22℃ | 6.8 | 6天后呈极浅黄色 |
| C | 80mL矿泉水 | 20g葡萄糖 | 22℃ | 7.1 | 13天后呈极浅黄色 |
| D | 80mL蒸馏水 | 5g葡萄糖 | 22℃ | 7 | 60天后仍无明显变化 |
| E | 80mL蒸馏水 | 30g葡萄糖 | 22℃ | 7 | 18天后呈极浅黄色 |
| F | 80mL蒸馏水 | 20g葡萄糖 | 0℃ | 7 | 60天后仍无明显变化 |
| G | 80mL蒸馏水 | 20g葡萄糖 | 60℃ | 7 | 12天后呈极浅黄色 |
| H | 80mL蒸馏水+1mL稀硫酸 | 20g葡萄糖 | 22℃ | 3 | 60天后仍无明显变化 |
| I | 80mL蒸馏水+1mL氢氧化钠溶液 | 20g葡萄糖 | 22℃ | 11 | 7分钟后呈极浅黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
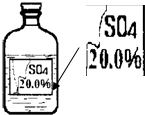 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
| 实验操作 | 实验现象 | 实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 NaOH NaOH 溶液 |
溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟标准比色卡对照 | 溶液pH小于7 |
猜想③成立 |
| 实验操作 | 实验现象 | 实验结论 | ||||||||
| 取该溶液少许于试管中, 向试管中加入少量NaOH溶液并加热, 向试管中加入少量NaOH溶液并加热, 将湿润的红色石蕊试纸放在试管口 将湿润的红色石蕊试纸放在试管口 |
有刺激性气味的气体产生, 有刺激性气味的气体产生, 红色石蕊试纸变蓝 红色石蕊试纸变蓝 |
猜想④成立,该反应的化学方程式为 (NH4)2SO4+2NaOH (NH4)2SO4+2NaOH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com