
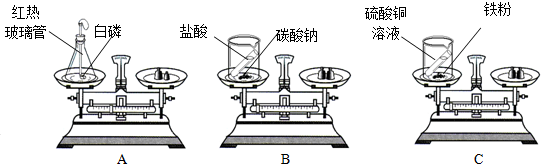
分析 (1)B实验在敞开烧杯中进行,反应的过程中要生成气体,所以B肯定不平衡.
(2)考虑白磷燃烧放热,瓶内压强增大;
(3)在化学反应里肯定不变的是:物质的总质量、元素的种类、元素的质量、原子的种类、原子的质量、原子的数目;
(4)根据实验现象AC装置天平平衡,而B装置天平失去平衡分析得出结论并反思评价.
解答 解:(1)实验B在敞开的仪器中进行,反应中要生成气体,故天平难以平衡
(2)磷燃烧产生热,装置中气体遇热膨胀,反应完成后热量散失,气体又会收缩,气球先变大后缩小;
(3)在化学反应里肯定不变的是:物质的总质量、元素的种类、元素的质量、原子的种类、原子的质量、原子的数目,可以据此选择为①⑤
(4)通过上述实验的探究,可知探究或验证反应物与生成物的质量关系时,若要用到有气体参加或生成的反应,应该在密闭容器中进行;
故答案为:(1)B;
(2)先变大后缩小;(3)①⑤;
(4)参加;生成.
点评 本题考查了质量守恒定律的验证,需要明确反应发生所需要的容器是密闭容器还是敞口容器选择的依据是说法有气体的反应和生成.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食醋与酒精 闻气味 | |
| B. | 空气与氧气 带火星的木条 | |
| C. | 水和双氧水 看颜色 | |
| D. | 一氧化碳与二氧化碳 燃着的木条 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用活性炭、纱布等自制的净水器净水 | |
| B. | 用花瓣液汁检验白醋、白酒的酸碱性 | |
| C. | 用食醋浸泡鸡蛋 | |
| D. | 用小苏打、柠檬酸、果汁等自制汽水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 分别称取36gNaCl、KNO3固体放入两只烧杯中,在20℃时分别加入100g水,充分搅拌后,有如图所示现象,请结合溶解度表,判断下列说法不正确的是( )
分别称取36gNaCl、KNO3固体放入两只烧杯中,在20℃时分别加入100g水,充分搅拌后,有如图所示现象,请结合溶解度表,判断下列说法不正确的是( )| 溶解度/g | 20℃ | 20℃ | 20℃ | 20℃ |
| NaCl | 35.8 | 36.0 | 36.6 | 37.3 |
| KNO3 | 20.9 | 31.6 | 63.9 | 110 |
| A. | 甲烧杯内为硝酸钾,乙烧杯内为氯化钠 | |
| B. | 甲烧杯内为饱和溶液,乙烧杯内为不饱和溶液 | |
| C. | 将温度升高40℃时,两溶液中溶质的质量分数相等 | |
| D. | 可用冷却热饱和溶液的方法得到大量的KNO3晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com