
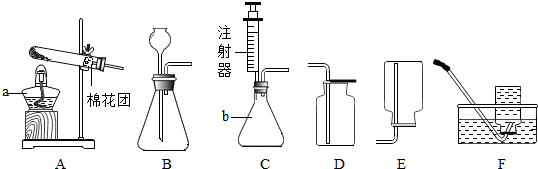
分析 酒精灯是常用的加热仪器,锥形瓶是常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.装置C的优点是:可以控制反应的速率;也可以将注射器连接到装置B的导管口处,用来检查装置的气密性.
解答 解:(1)酒精灯是常用的加热仪器,锥形瓶是常用的反应容器,故答案为:酒精灯;锥形瓶;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;故答案为:A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.装置C的优点是:可以控制反应的速率;也可以将注射器连接到装置B的导管口处,用来检查装置的气密性;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;可以控制反应的速率;检查装置的气密性;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 产生气泡 | Ⅰ | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
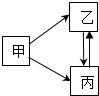 甲、乙、丙是初中化学中常见的物质,其转化关系如图所示(反应条件已省略).甲、乙、丙三种物质中都含有同一种元素.
甲、乙、丙是初中化学中常见的物质,其转化关系如图所示(反应条件已省略).甲、乙、丙三种物质中都含有同一种元素.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蜡烛在空气中燃烧生成二氧化碳和水 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰 | |
| C. | 木炭在氧气中燃烧,发出黄色火焰,生成有刺激性气味的气体 | |
| D. | 氢气在空气中燃烧发出淡蓝色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | a | b | c | d |
| 反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
| 反应后质量/g | 待测 | 2.56 | 7.20 | 0.50 |
| A. | a和b是反应物,d可能是催化剂 | |
| B. | 反应后a物质质量为3.84g | |
| C. | c物质中其原子种类、数目和a、b物质中原子种类、数目相同 | |
| D. | 若物质a与b的相对分子质量之比为2:1,则化学反应中a与b的化学计量数比为1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 点燃蜡烛,生成二氧化碳和水 | |
| B. | 铁在氧气中燃烧,火星四射,生成黑色固体 | |
| C. | 硫酸铜晶体与氢氧化钠固体混合后生成蓝色沉淀 | |
| D. | 红磷在氧气中燃烧,有蓝色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com