
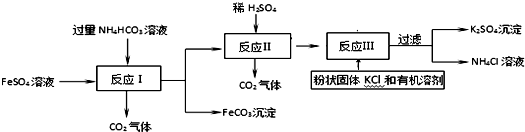
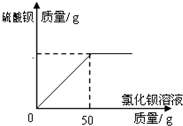
 (6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数?
(6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数? 分析 (1)为了不带入新的杂质,应该用铁除去FeSO4 溶液中的杂质Fe2(SO4)3;
(2)反应Ⅰ所得混合物过滤后所得滤液的溶质有反应生成的硫酸铵和过量的碳酸氢铵;
(3)碳酸氢铵能和稀硫酸反应生成硫酸铵、水和二氧化碳;
(4)硫酸铵和氯化钾反应生成硫酸钾和氯化铵;
因为硫酸钾在有机溶剂中的溶解度很小,因此加入有机溶剂能使硫酸钾从溶液中析出;
(5)饱和硫酸钾溶液中不能溶解硫酸钾,但是能够溶解其它一些溶质;
(6)硫酸钾和氯化钡反应生成白色沉淀硫酸钡和氯化钾,根据图中提供的信息和提供的数据及其反应的化学方程式可以进行相关方面的计算.
解答 解:(1)反应I前除去FeSO4 溶液中的杂质Fe2(SO4)3需加入铁屑,而加入锌、铜会带入新的杂质.
故填:B.
(2)反应Ⅰ所得混合物过滤后所得滤液的溶质有过量的碳酸氢铵和反应生成的硫酸铵.
故填:NH4HCO3和(NH4)2SO4.
(3)反应Ⅱ中,碳酸氢铵能和稀硫酸反应生成硫酸铵、水和二氧化碳,因此加入稀硫酸的作用是除去过量的碳酸氢铵.
故填:除去过量的碳酸氢铵.
(4)硫酸铵和氯化钾反应生成硫酸钾和氯化铵,反应的化学方程式为:(NH4)2SO4+2KCl=K2SO4+2NH4Cl;
工业生产上常在反应Ⅲ过程中加入一定量的有机溶剂,其目的是减小硫酸钾的溶解度,使硫酸钾析出.
故填:(NH4)2SO4+2KCl=K2SO4+2NH4Cl;减小硫酸钾的溶解度,使硫酸钾析出.
(5)反应Ⅲ得到的K2SO4固体沉淀需要经过洗涤,才能得到纯度高的产品.洗涤时最好用K2SO4饱和溶液,这样既能够保证硫酸钾不损失,又能够除去硫酸钾中的杂质.
故填:C.
(6)设样品中硫酸钾质量为x,
BaCl2+K2SO4═BaSO4↓+2KCl,
208 174
50g×20.8% x
$\frac{208}{174}=\frac{50g×20.8%}{x}$
x=8.7g,
样品中硫酸钾的质量分数为:$\frac{8.7g}{10g}$×100%=87%,
答:样品中硫酸钾的质量分数为87%.
点评 本题主要考查物质的性质和根据化学方程式进行计算的能力,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:推断题
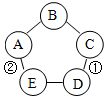 如图表示的物质A~E相互的关系(“-”表示两端的物质能发生化学反应).其中A广泛用于玻璃、造纸、纺织和洗涤剂的生产等;C是一种蓝色溶液;D是使用最多的金属材料.
如图表示的物质A~E相互的关系(“-”表示两端的物质能发生化学反应).其中A广泛用于玻璃、造纸、纺织和洗涤剂的生产等;C是一种蓝色溶液;D是使用最多的金属材料.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
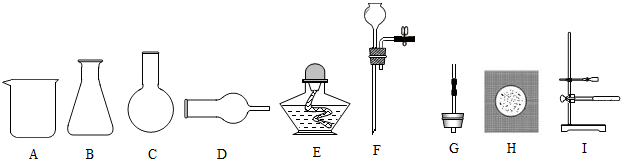
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com