
| A. | 量筒--用于液体药品反应 | B. | 试管--用于少量试剂反应容器 | ||
| C. | 胶头滴管--用于滴加少量液体 | D. | 集气瓶--用于收集和储存少量气体 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验编号 | 试剂 | 前10 min内产生的 氢气体积(mL) | |
| 锌的纯度 | 稀硫酸的体积和浓度 | ||
| a | 纯锌 | 30 mL 30% | 564.3 |
| b | 含杂质的锌 | 30 mL 30% | 634.7 |
| c | 纯锌 | 30 mL 20% | 449.3 |
| d | 纯锌 | 40 mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
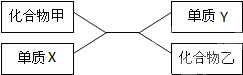 根据如图中化合物与单质相互转化的关系回答:
根据如图中化合物与单质相互转化的关系回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
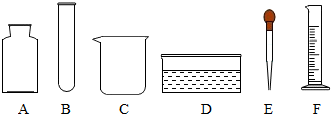
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 20℃ | 8%Na2CO3溶液 | 8%NaHCO3溶液 |
| pH | 10.6 | 8.0 |
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
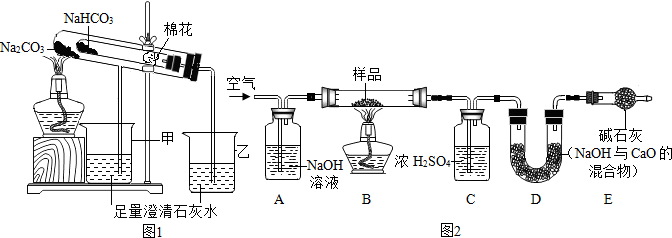
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是一种重要的自然资源.
水是一种重要的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
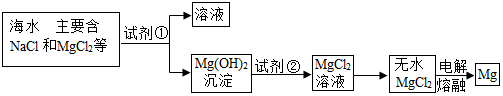
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com