
图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
.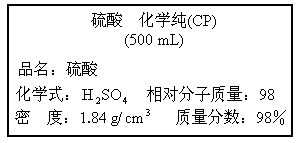
(1)该硫酸未开启前质量为________g(盛装的瓶子除外);其中溶质的质量为________g.
(2)
欲配制500g溶质的质量分数为19.6%的稀硫酸,需这种硫酸________mL?(计算结果保留一位小数).(3)
把(2)中配成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?科目:初中化学 来源: 题型:阅读理解
 如图所示是市某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请认真阅读后解答下列问题.
如图所示是市某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请认真阅读后解答下列问题.| 98 |
| 2 |
| 50×19.6% |
| y |
| 98 |
| 2 |
| 50×19.6% |
| y |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:
如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,阅读后计算:查看答案和解析>>
科目:初中化学 来源:学力提升指导丛书 2006年初中化学总复习上册 题型:038
下图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:

(1)该硫酸未开启前质量为________g(盛装的瓶子除外);其中溶质的质量为________g.
(2)欲配制500 g溶质质量分数为19.6%的稀硫酸,需这种硫酸多少毫升?(计算结果保留一位小数)
(3)把(2)中配成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:038
图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
.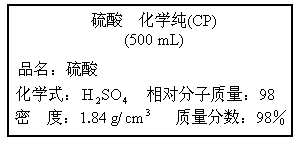
(1)该硫酸未开启前质量为________g(盛装的瓶子除外);其中溶质的质量为________g.
(2)
欲配制500g溶质的质量分数为19.6%的稀硫酸,需这种硫酸________mL?(计算结果保留一位小数).(3)
把(2)中配成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com