
【题目】现有A、B、C、D四种元素,已知A元素中的一种原子核内无中子;B元素是地壳中含量最丰富的非金属元素;C元素形成的纯净物在B元素形成的纯净物中充分燃烧,产生能使澄清石灰水变浑浊的气体;D元素是地壳中含量第二多的金属元素。
(1)请写出四种元素的元素符号:A___________ B___________ C___________ D___________
(2)写出AB两种元素形成的纯净物的名称是______________。
(3)写出D元素形成的纯净物在B元素形成的纯净物中燃烧的文字表达式_____________。
【答案】H O C Fe 水或过氧化氢 铁+氧气![]() 四氧化三铁
四氧化三铁
【解析】
(1)A、B、C、D四种元素,已知A元素中的一种原子核内无中子,所以A是氢元素,B元素是地壳中含量最丰富的非金属元素,所以B是氧元素,C元素形成的纯净物在B元素形成的纯净物中充分燃烧,产生能使澄清石灰水变浑浊的气体,所以C是碳元素,D元素是地壳中含量第二多的金属元素,所以D是铁元素,经过验证,推导正确,所以A是H,B是O,C是C,D是Fe;
(2)由分析知,A是氢元素,B是氧元素,故AB两种元素形成的纯净物的名称是水或过氧化氢;
(3)D元素形成的纯净物在B元素形成的纯净物中燃烧的反应是铁和氧气在点燃的条件下生成四氧化三铁,文字表达式是:铁+氧气![]() 四氧化三铁。
四氧化三铁。
故答案为:(1)H,O,C,Fe;
(2)水或过氧化氢;
(3)铁+氧气![]() 四氧化三铁。
四氧化三铁。


科目:初中化学 来源: 题型:
【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。

(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N )就是其中的一种。请回答下列问题:
(1)丙氨酸由___________种元素组成,其分子共有___个原子,
(2)计算丙氨酸的相对分子质量________
(3)计算丙氨酸中氮元素的质量分数________(精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】按要求填空
(1)保持氨气这种物质化学性质的最小微粒_____(填微粒名称);
(2)硫在空气或纯氧中燃烧实验中所用的金属仪器_____(填仪器名称);
(3)汞这种金属是由_________________________构成的(填微粒名称);
(4)实验过程中要注意节约药品,如果实验过程中没有说明药品用量应该按_____原则 取用药品。液体只需 1-2mL,固体只需__________________________;
(5)量取一定量液体时需要用到量筒,量液时,量筒必须要放平,视线要_____;
(6)近年来膜分离技术得到迅速发展。利用这一技术在一定压力下,让空气通过具有富集 氧气功能的薄膜,得到的含氧量很高的富氧空气属于_____物,利用这种膜进行多级分 离可以实现含氧量超过 90%,这种变化属于_____变化;
(7)下面是在汽车尾气治理过程中有关化学反应的微观示意图。图中所示反应的化学符号表达式为__________________。
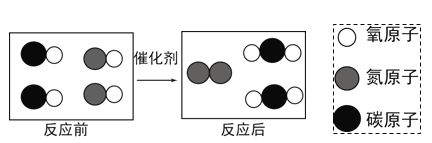
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气中氧气含量测定的再认识。
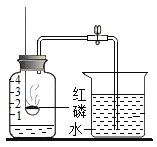
请回忆教材用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)实验时,取下橡胶塞,点燃红磷迅速伸入集气瓶中,这时看到的现象是___________;红磷燃烧时红磷燃烧的反应符号表达式_____________,属________反应(填“化合”或“分解”)。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内__________减小,烧杯中水倒吸到集气瓶。但是实验结果液面往往偏低,其可能原因是________。
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧, 因此通过上述实验,测置结果与理论值误差较大。
(实验改进)
Ⅰ.根据铁在空气中生锈的原理设计下图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
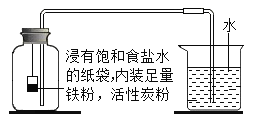
Ⅱ.测得实验数据如下表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)铁生锈过程发生复杂的化学反应(一个缓慢氧化的过程),最终生成铁锈。根据表中的数据计算,改进实验后测得空气中氧气体积分数是________(计算结果精确到0.1 %) 。
(2)从实验原理角度分析,改进后的实验结果比前者准确度更高的原因是:________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】按要求写出反应的文字表达式
① 能生成一种无色液体和无色气体的反应____________________
② 燃烧产生白烟的化学反应__________________
③ 白色固体和黑色固体反应生成无色气体的反应___________________
④ 在空气中燃烧产生淡蓝色火焰的反应________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是实验室常用仪器,据图回答问题:
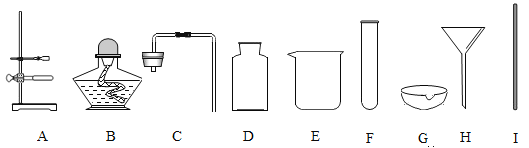
(1)仪器E的名称是烧杯,仪器B的名称是_____。
(2)实验室可用高锰酸钾制取氧气,反应的符号表达式_____,利用高锰酸钾制取并收集氧气,需从上述仪器中选择_____ (填序号)。
(3)可用排水法收集氧气,是因为_____。某同学用排水法收集了一瓶氧气,将带火星的木条伸入集气瓶中,木条没有复燃,你认为可能的原因是_____(答一条即可)。向上排空气法收集氧气时,验满的方法是_____。
(4)与集气瓶配套使用的玻璃片一般一面为光滑面,另一面为磨砂面,收集的气体用玻璃片的_____ (选填“光滑面”或“磨砂面”)盖住集气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com