
| 编号 | 溶液 | 溶质化学式 |
| ① | 澄清的石灰水 | Ca(OH)2 |
| ② | 医疗消毒用高锰酸钾溶液(俗称紫药水) | KMnO4 |
| ③ | 0.9%的氯化钠注射液(俗称生理盐水) | NaCl |
| ④ | 38°“稻花香”白酒 | C2H5OH |
| ⑤ | 硫酸溶液 | H2SO4 |
| ⑥ | 家用醋酸 | CH3COOH |
| ⑦ | 碘酒 | I2 |
| ⑧ | 生石灰配成的水溶液 | Ca(OH)2 |
| ⑨ | 稀盐酸 | HCl |
分析 固体、气体溶于液体时固体、气体是溶质,液体是溶剂,溶液的命名是溶质的溶剂溶液;只要有水,水一定是溶剂.
解答 解:澄清的石灰水是氢氧化钙溶于水形成的,所以溶质是氢氧化钙,溶剂是水,化学式是:Ca(OH)2;医疗消毒用高锰酸钾溶液(俗称紫药水)溶质是高锰酸钾溶剂是水,化学式是:KMnO4;生理盐水是氯化钠溶于水形成的,溶质是氯化钠,溶剂是水,所以化学式是:NaCl;38°“稻花香”白酒中溶质是酒精,溶剂是水,化学式是:C2H5OH;稀硫酸是硫酸溶于水形成的溶质是硫酸,溶剂是水,所以化学式是H2SO4;家用醋酸中溶质是醋酸,溶剂是水;化学是:CH3COOH;碘酒是碘溶于酒精形成的,溶质是碘,溶剂是酒精,所以碘是溶质,酒精是溶剂,化学式是:I2.生石灰与水反应生成氢氧化钙,故生石灰配成的水溶液中,溶质是氢氧化钙,溶剂是水;化学式:Ca(OH)2;稀盐酸的溶质是氯化氢气体,溶剂是水,化学式是HCl.
故答案为:Ca(OH)2;KMnO4;NaCl;C2H5OH;H2SO4;I2;Ca(OH)2;HCl.
点评 解答本题关键是要知道溶质和溶剂的判断方法,并能灵活运用进行正确的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
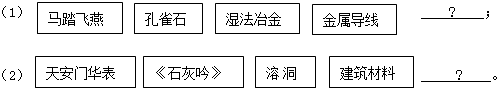
| A. | Fe CaO | B. | Cu CaO | C. | Fe Ca(OH)2 | D. | Cu CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 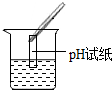 |  |  |
| 实验现象 | 试纸变色,比照比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ,请回答下列问题:
,请回答下列问题:
 ,W离子的离子符号为Na+;
,W离子的离子符号为Na+;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮气--性质稳定--保护气 | B. | 石墨--导电性--作电极 | ||
| C. | 酒精--可燃性--消毒剂 | D. | 干冰--升华吸热--人工降雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | |
| 实验1 | 取样与试管中,加入食醋 并将产生气体通入澄清石灰水中. | 有气泡产生 石灰水变浑浊. |
| 实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com