
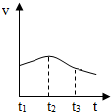
 以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
以下是甲、乙两同学对有关镁与盐酸反应的系列研究.分析 研究一、
(1)反应中试管外壁发烫,说明是放热反应
(2)根据温度的变化分析反应速度的问题
研究二、
(3)依据酸碱性溶液pH的大小进行分析判断;
(4)根据甲乙同学的不同猜想分析两人必做的实验操作,根据反应的现象结合质量守恒定律的有关应用对化学方程式进行书写即可;
(5)根据活泼金属与水反应的条件分析即可;
(6)根据钠镁活动性强弱的关系分析三种金属中活动性最强的物质即可.
解答 解:研究一、
(1)反应中试管外壁发烫,说明是放热反应
(2)化学反应速率与温度有关,温度越高,化学反应速率越快,t1~t2时间内,镁与盐酸反应放热,温度越高反应速度越快
研究二、
发现问题:依据酸碱性溶液pH的大小进行分析判断;
(3)pH小于7的溶液呈酸性,所以该溶液显酸性;
实验思考:要确定反应后溶液的酸碱性,因溶液中均含有氯化镁,因此甲乙两同学都必须测氯化镁溶液的酸碱性;
使用pH试纸的方法正确的是将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上;
(4)在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,说明生成了碱性物质,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧说明生成了可燃性气体,根据质量守恒定律中反应前后元素的种类不变,可知该反应的产物是氢氧化镁和氢气,其方程式为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
(5)依据钠与水反应不需要加热,而镁与水反应需要加热可知:金属与水的反应与金属活动性顺序有关.
研究四:设镁的质量为x,镁与盐酸反应生成氯化镁的质量为y
Mg+2HCl═MgCl2+H2↑
24 95 2
x y 0.2g
$\frac{24}{x}=\frac{95}{y}=\frac{2}{0.2g}$
x=2.4g y=9.5g
氧化镁的质量为3.2g-2.4g=0.8g
设氧化镁与盐酸反应生成氯化镁的质量为Z
MgO+2HCl═MgCl2+H2O
40 95
0.8g z
$\frac{40}{0.8g}=\frac{95}{z}$
z=1.9g
所得溶液的溶质质量分数=$\frac{9.5g+1.9g}{3.2g+100g-0.2g}$=11.1%
答:(1)镁的质量为2.4g,(2)所得溶液的溶质质量分数为11.1%
故答案为:研究一、
(1)放热;
(2)镁与盐酸反应放热,温度越高反应速度越快;
研究二、
(3)酸;氯化镁;C;
(4)Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
(5)有关;
(6)2.4g;11.1%.
点评 此题是一道实验探究与计算相结合的题目,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析.


科目:初中化学 来源: 题型:选择题
| A. | 维生素A中碳、氢、氧三种元素的质量比为20:30:1 | |
| B. | 维生素A的相对分子质量为286g | |
| C. | 维生素不是人体必需的营养物质 | |
| D. | β一胡萝卜素中碳元素的质量分数约为89.55% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 | t7 | t8 |
| 氢氧化钠溶液增加的质量/g | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  向氢氧化钠溶液中加水 | |
| B. | 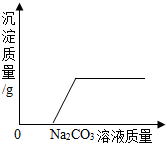 向一定量的氯化钙和盐酸的混合溶液中不断加入碳酸钠溶液 | |
| C. |  水的电解 | |
| D. | 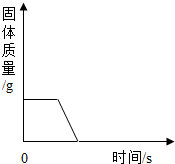 加热碱式碳酸铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+、Cl-、Ba2+、CO32- | B. | Ag+、I-、K+、NO3- | ||
| C. | K+、OH-、Cl-、Na+ | D. | Fe3+、Cl-、NO3-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com