
| A. | RbOH溶液能与CO2反应 | |
| B. | RbOH溶液与硫酸反应生成的盐的化学式为RbSO4 | |
| C. | RbOH溶液能使酚酞溶液变红 | |
| D. | RbOH在水中能电离出Rb+、OH- |
分析 A.RbOH溶液具有碱的性质;
B.复分解反应中元素的化合价不变;
C.碱溶液能使无色酚酞试液变红色;
D.RbOH是强碱,在水溶液里完全电离.
解答 解:A.RbOH也是强碱,也会和非金属氧化物CO2反应,故A正确;
B、RbOH与硫酸反应生成的盐的化学式为Cs2SO4,故B错误;
C、RbOH也是强碱,在水溶液里完全电离,其水溶液呈碱性,所以滴入无色酚酞试液后溶液呈红色,故C正确;
D、Rb的金属性大于Na,NaOH是强碱,则CsOH也是强碱,在水溶液里完全电离,电离方程式为RbOH═Rb++OH-,故D正确;
故选:B.
点评 本题考查了RbOH的性质,根据碱的性质、复分解反应条件、电解质强弱等知识点来分析解答即可,题目难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
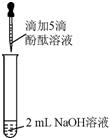 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.| 实验 | 实验操作 | 实验现象 |
| 1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 |
| 2 | 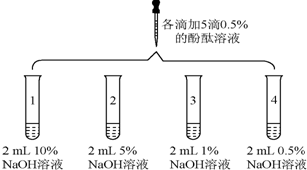 | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料.
轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 称 量 项 目 | 质量(克) |
| 所取样品 | 9.30 |
| 锥形瓶质量 | 41.20 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部样品后,第一次称量的质量 | 148.50 |
| 锥形瓶+稀盐酸质量+全部样品后,第二次称量的质量 | 148.30 |
| 锥形瓶+稀盐酸质量+全部样品后,第三次称量的质量 | 148.30 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 | 5 |
| 现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com