
| 实验序号 | 实验过程 | 实验现象 |
| 1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
| 2 | 铁粉和铁片分别与15%盐酸反应 | 铁粉产生气体快 |
| 3 | 铁片分别与5%盐酸和15%盐酸反应 | 15%盐酸产生气体快 |
分析 (1)根据金属的物理性质解答;
(2)根据铝和氧气反应生成氧化铝解答;
(3)本题是对影响金属与酸反应快慢的不同的因素的探究,实验1用的是镁粉和铁粉分别与5%盐酸反应,实验2用的是铁粉和铁片分别与10%盐酸反应,实验3是铁片分别与5%盐酸和10%盐酸反应,据此结合控制变量法,即其它量保持不变,控制一个变量,进行分析解答;
(4)①根据锌的活动性比银强,利用锌与硝酸银的反应规律,写出反应的化学方程式;
②根据三种金属的活动性顺序锌铜银,推断将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中可能发生的反应,得到固体和蓝色溶液,对反应后溶液的组成进行猜测;
解答 解:
(1)铜可用来制作导线,是因为其具有良好的延展性和导电性;
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是铝和氧气反应生成的氧化铝;
(3)实验1:镁粉和铁粉分别与5%盐酸反应,镁粉产生气体的速度快,说明活动性越强,反应速率越快;
实验2:铁粉和铁片分别与10%盐酸反应,铁粉与盐酸的接触面积比铁片与酸的接触面积大,而铁粉的产生气体快,说明金属与酸反应的速率与金属和酸的接触面积有关,即接触面积越大反应越快;
实验3:铁片分别与5%盐酸和10%盐酸反应,10%盐酸产生气体快,说明金属与酸反应的速率是否与酸的浓度有关,即浓度越大反应速率越快.
(4)①锌置换硝酸银中的银,同时得到硝酸锌,反应的化学方程式为Zn+2AgNO3═Zn(NO3)2+2Ag;
②由得到溶液呈蓝色,说明铜粉与硝酸银发生了反应,反应后溶液中一定含有硝酸铜;由于锌的活动性比铜强,锌会先于铜与硝酸银反应且锌粉可与硝酸铜反应,因此可判断锌粉已完全反应,溶液中一定含有硝酸锌;硝酸银是否完全反应则成为所要猜测的两种可能,若硝酸银完全反应,则溶液中只含有硝酸锌、硝酸铜,若硝酸银有剩余,则溶液中含有硝酸锌、硝酸铜、硝酸银;
故答案为:
(1)导电性;
(2)氧化铝;
(3)a.金属活动性,活动性越强,反应速率越快;b.金属与酸的接触面,接触面越大,反应越快;c.酸的浓度,酸的浓度越大,反应越快(合理即可).
(4)①Zn+2AgNO3═Zn(NO3)2+2Ag;②Zn2+、Cu2+.
点评 本题是对影响金属与酸反应快慢不同的因素的探究,分析时可利用了控制变量法,从金属的活动性、金属的状态和酸的浓度等不同的角度探究某一个量对反应的影响.


科目:初中化学 来源: 题型:选择题
| A. | 12.4g | B. | 10.8g | C. | 9.2g | D. | 7.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠在20℃时的溶解度是36g,则100g的氯化钠溶液中含有氯化钠36g | |
| B. | 含氧元素的化合物一定是氧化物 | |
| C. | 氧化反应一定是化合反应 | |
| D. | 化合物一定是由不同种元素组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 图A为镁原子的结构示意图,图B为镁元素在元素周期表中的部分信息.下列叙述错误的是( )
图A为镁原子的结构示意图,图B为镁元素在元素周期表中的部分信息.下列叙述错误的是( )| A. | 镁离子核外有两个电子层 | |
| B. | 镁原子在化学反应中易失去电子 | |
| C. | 镁元素的原子序数等于镁元素原子的核内质子数 | |
| D. | 由于元素原子的核外电子层数与元素所在的周期数相同,可知镁元素位于第2周期 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
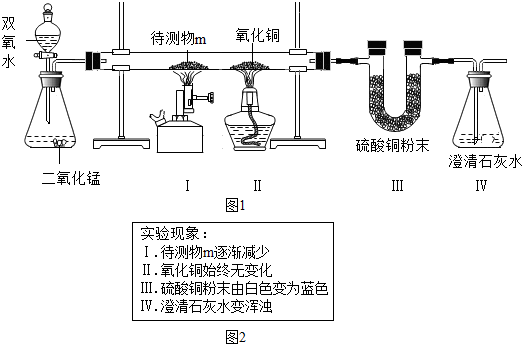
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
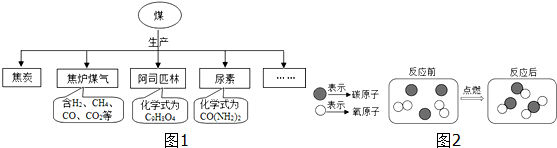
 b、
b、 c、
c、 d、
d、
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
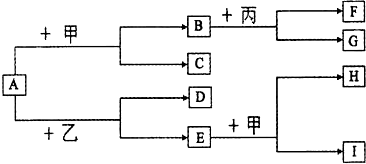
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com