

 =14.25g
=14.25g =
= =
= ,x=12g,y=8.7g
,x=12g,y=8.7g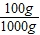 =6g
=6g =
= =
= ,z=4g,w=2.9g
,z=4g,w=2.9g Mg+Cl2↑得
Mg+Cl2↑得 =
= =
= ,m=4.8g,n=14.2g
,m=4.8g,n=14.2g

科目:初中化学 来源: 题型:058
(2007
,江苏省南通市,30)海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.图示是我市某盐场苦卤中部分成分含量柱形图.试计算:
(1)
若使100g该苦卤中的 和
和 完全转化为
完全转化为 沉淀,需要20%NaOH溶液多少克?
沉淀,需要20%NaOH溶液多少克?
(2)
将上述沉淀完全转化为无水 ,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0g/L)?
,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0g/L)?查看答案和解析>>
科目:初中化学 来源:2008年江苏省苏州市吴江市中考化学模拟试卷(解析版) 题型:选择题
查看答案和解析>>
科目:初中化学 来源:2007年江苏省南通市中考化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2007年江苏省南通市中考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com