
15、下图是元素周期表中第二周期的部分元素,在化学反应中,从左到右原子得电子能力逐渐增强.从图表中获得的信息正确的是( )
|
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
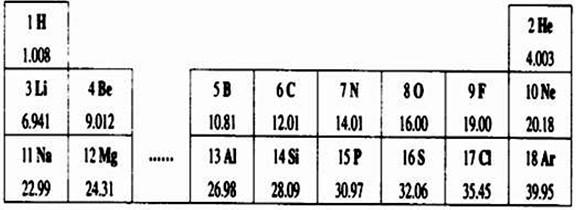
| 第2周期 | 3 Li 6.991 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 第3周期 | 11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.02 |
17 Cl 35.45 |
X Ar 39.95 |
查看答案和解析>>
科目:初中化学 来源: 题型:
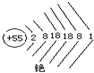 铯元素(Cs)是元素周期表中第55号元素,其相对原子质量为133,其原子结构示意图
铯元素(Cs)是元素周期表中第55号元素,其相对原子质量为133,其原子结构示意图查看答案和解析>>
科目:初中化学 来源: 题型:
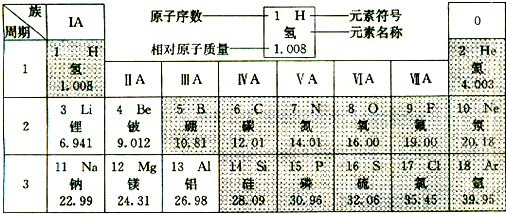


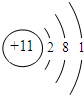

查看答案和解析>>
科目:初中化学 来源:2012-2013学年广东佛山高明区九年级上学期课堂教学质量抽测化学试卷(解析版) 题型:选择题
如下图是元素周期表中第三周期部分元素的微粒结构示意图,依照此示意图,下列描述正确的是
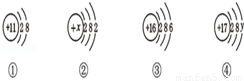
A.示意图①、②、③、④表示的全部是原子结构
B.示意图②的核电荷数x=12
C.示意图④若表示的是离子结构,则它的最外层电子数y=7
D.示意图①的最外层电子数为8,所以它是稀有气体元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com