
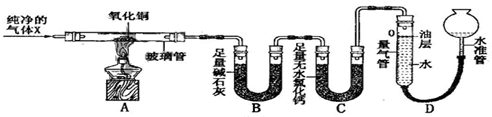
| 数据编号 测量项目 | Ⅰ | Ⅱ |
| 玻璃管(含药品)的质量/g | 52.40 | 51.92 |
| B装置(含药品)的质量/g | 102.00 | 102.54 |
| 氮气的体积/mL | / | 243.5 |
分析 由题目的信息可知:B装置中的碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应,因此只吸收水蒸气,增加的质量就是生成的水的质量:102.54g-102.00g=0.54g;氧化铜中氧元素的质量=52.40g-51.92g=0.48g;由此推知,气体X中一定没有氧元素,因为0.54g水中氧元素的质量=0.54g×$\frac{16}{18}$=0.48g;B装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙;实验过程中,当观察到量气管内液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃冷却的目的是防止灼热的铜被氧化;根据元素的质量比求x的化学式,有关的计算要准确.
解答 解:(1)B装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙,故答案为:CaO+H2O=Ca(OH)2
(2)实验过程中,当观察到量气管内液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃冷却的目的是防止灼热的铜被氧化;故答案为:量气管内液面不再下降;防止灼热的铜被氧化;
(3)B装置中的碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应,因此只吸收水蒸气,增加的质量就是生成的水的质量:102.54g-102.00g=0.54g,0.54g水中氧元素的质量=0.54g×$\frac{16}{18}$=0.48g,氧化铜中氧元素的质量=52.40g-51.92g=0.48g,由此推知,气体X中一定没有氧元素;故答案为:0.54;0.48;没有;
(4)243.5mL=0.2345L,设气体x的化学式为NmHn
$\frac{氮元素质量}{氢元素质量}$=$\frac{14m}{n}$=$\frac{1.15g/L×0.243}{0.54g-0.48g}$,
所以 m:n=1:3
所以x的化学式为:NH3;
故答案为:NH3.
点评 考点既考查了实验步骤的设计,又考查了化学方程式的书写和有关的计算等,还对实验进行了评价,综合性比较强,有关的计算要正确.同学们要具体分析,综合掌握.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,采用如图所示装置将上层液体进行过滤,请问:
小红同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,采用如图所示装置将上层液体进行过滤,请问:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 16.2% | B. | 32.4% | C. | 41% | D. | 82% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含有氧元素 | B. | 一定含有钠元素和氧元素 | ||
| C. | 只含有钠元素 | D. | 一定含有钠元素,可能含有氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 剩余固体不含高锰酸钾 | |
| B. | 剩余固体含有高锰酸钾 | |
| C. | 剩余固体与原高锰酸钾的质量比为71:79 | |
| D. | 剩余固体与原高锰酸钾的质量比大于71:79 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com