
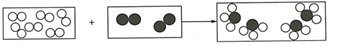
 ”为A2,“
”为A2,“ ”为B2,已知M1(B2)=28,若参加反应的A2质量为9g,生成的产物质量为51g,则M1(生成物)=17.
”为B2,已知M1(B2)=28,若参加反应的A2质量为9g,生成的产物质量为51g,则M1(生成物)=17. 分析 由反应的微观示意图可知,反应前的6个A2分子全部反应,而3个B2分子中有1个分子剩余只有2个分子参加反应,且反应生成4个BA3分子.由反应的微观示意图,可确定反应的化学方程式,根据化学方程式完成问题的解答.
解答 解:根据反应微观示意图,各物质反应的微粒个数关系是: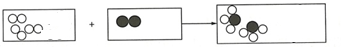
该反应的化学方程式可表示为3A2+B2═2BA3;若9g A2完全反应,得到51g产物,根据质量守恒定律,消耗B2的质量=51g-9g=42g,
设生成物的相对分子质量为x
3A2+B2═2BA3
28 2x
42g 1g
$\frac{28}{2x}=\frac{42g}{51g}$ 解得:x=17
x=17
故答案为:17
点评 观察分子模型时,分子由原子构成,构成相同的分子为同种物质的分子,构成不同的分子为不同种物质的分子,含有不同种分子的物质为混合物.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 计算及应用题:
计算及应用题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 试管编号 | A | B |
| 试管内药品 | 1g块状大理石与5mL 25%稀硫酸 | 1g粉末状大理石与5mL 25%稀硫酸 |
| 现象和比较 | 有少量气泡 | 迅速产生较多气泡 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com