某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①生产原料粗盐中含有少量可溶性杂质(MgCl
2和CaCl
2)及不溶性杂质.
②生产原理反应(2):NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl,分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
③氯化铵分解的化学方程式是NH
4Cl
NH
3↑+HCl↑.
④部分生产流程如图1所示:
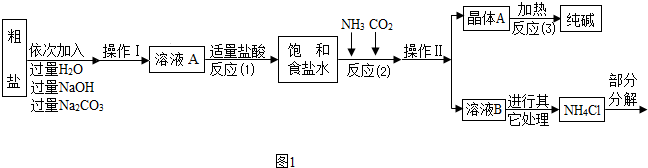
【问题讨论】
(1)①溶液A中的溶质有NaCl和
、
,②操作Ⅱ的名称为
.
③流程中NaOH溶液的作用是除去粗盐中的
.
④写出加入Na
2CO
3溶液所发生反应的化学方程式
.写出加入盐酸溶液所发生反应的化学方程式
、
.
(2)上述生产流程中可循环使用的是
(填序号).A.CO
2 B.NH
3 C.HCl D.NaOH
【组成探究一】(3)①晶体A受热分解的化学方程式为
.
②设计实验检验纯碱样品中是否混有晶体A,请完成下表:
【组成探究二】(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO
3,再滴加AgNO
3溶液,有白色沉淀.产生沉淀的方程式为
,由此确定纯碱样品含有杂质NaCl.
【组成探究三】(5)同学们为了测定该纯碱样品的纯度,设计了如图2实验:

①判断加入氯化钡溶液是否过量的合适方法是
,然后观察现象判断.
A.静置混合物X,向上层清液中再滴少许氯化钡溶液 B.向滤液Y中滴加少许氯化钡溶液
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加
,然后观察现象判断.
A.氯化钡溶液 B.稀硫酸 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数为
(写出计算过程)