
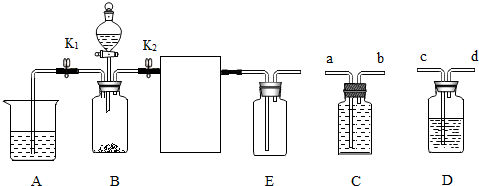
分析 (1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.C装置的作用是:盐酸的浓度大,挥发出氯化氢气体,因此开始后,B中并未观察到明显现象;当在A、B装置之间增加了C装置后,NaHCO3+HCl=NaCl+H2O+CO2↑当把氯化氢气体反应掉以后,就会看到澄清的石灰水变浑浊;将C装置中装满饱和碳酸氢钠溶液,即可用于收集二氧化碳,则二氧化碳应从b口进入,因为二氧化碳的密度比碳酸氢钠溶液的密度小.
(2)根据二氧化碳和水会生成碳酸,碳酸能使紫色石蕊变成红色进行分析;
解答 解:(1)制取纯净的二氧化碳:进行此实验时,将C装置ba两端分别与B、E装置连接.已知A中液体为澄清石灰水,B中固体为大理石,C中液体为饱和碳酸氢钠溶液,C装置的作用是:盐酸的浓度大,挥发出氯化氢气体,因此开始后,B中并未观察到明显现象;当在E、B装置之间增加了C装置后,NaHCO3+HCl=NaCl+H2O+CO2↑当把氯化氢气体反应掉以后,就会看到澄清的石灰水变浑浊;打开K1,关闭K2,将分液漏斗中的稀盐酸滴入B中,关闭分液漏斗的活塞.B中碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可,故发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;当A中出现大量浑浊时,后续操作为打开K2,关闭K1,可在C中收集到较纯净的二氧化碳.
(2)已知A中液体为紫色石蕊溶液,而CO2具有的化学性质是:CO2+H2O=H2CO3;观察到A中紫色石蕊溶液变红,E中干燥紫色石蕊小花不变红,二氧化碳和水会生成碳酸,碳酸能使紫色石蕊变成红色,而CO2不能,故答案为:H2O+CO2═H2CO3;A中紫色石蕊溶液变红,E中干燥紫色石蕊小花不变红;
故答案为:
(1)ba;CaCO3+2HCl═CaCl2+H2O+CO2↑; 打开K2,关闭K1;
(2)CO2+H2O═H2CO3; A中紫色石蕊溶液变红,E中干燥紫色石蕊小花不变红.
点评 本考点主要考查了二氧化碳的制取、检验和收集,同时也考查了化学方程式的书写,综合性比较强.要加强记忆,理解应用,本考点是中考的重要考点之一,主要出现在实验题中.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 金刚石、石墨的物理性质相差很大 | 因为其原子的排列方式不同 |
| B | 氢氧化钠溶液、碳酸钠溶液、氨水都能使酚酞变红 | 因为都是碱溶液 |
| C | 人需要从食物中摄取维生素 | 是为生命活动提供能量 |
| D | 用灯帽盖灭酒精灯和用嘴吹灭蜡烛 | 都将燃烧着的可燃物与空气隔绝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加热时间 (小时) | 焦谷氨酸钠含量(%) | ||
| 100℃ | 107℃ | 115℃ | |
| 0.5 | 0.3 | 0.4 | 0.7 |
| 1.0 | 0.6 | 0.9 | 1.4 |
| 2.0 | 1.1 | 1.9 | 2.8 |
| 4.0 | 2.1 | 3.6 | 5.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 良好的饮食习惯有利于健康,合理的饮食结构应该是“粗细搭配、荤素搭配”以摄入均衡的营养.
良好的饮食习惯有利于健康,合理的饮食结构应该是“粗细搭配、荤素搭配”以摄入均衡的营养.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com