
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的废液于试管中,向其中加入Na2CO3溶液至过量 | 只有白色沉淀生成 | 猜想Ⅰ正确 |
| 先气泡产生 后白色沉淀生成 | 猜想Ⅱ正确 |
分析 (1)根据实验室制取二氧化碳是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
(2)【猜想与假设】根据盐酸是否完全反应分析;【进行实验】根据碳酸钠与氯化钙反应生成沉淀分析;根据盐酸与碳酸钠反应生成二氧化碳分析;
【反思拓展】根据生成物及物质的相互反应分析;
解答 解:(1)实验室制取二氧化碳是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)【猜想与假设】【进行实验】实验室制取二氧化碳是碳酸钙和盐酸反应,如果恰好完全反应,则溶液中只有氯化钙,如果盐酸过量,则溶液中有氯化钙和氯化氢;故填:氯化钙和盐酸;
【进行实验】取少量反应后的废液于试管中,向其中加入Na2CO3溶液至过量,如果只有沉淀生成,说明溶液中只含有氯化钙,则猜想1正确;如果先有气泡出现,再有沉淀生成,说明溶液中既有盐酸又有氯化钙,则猜想2正确;故填:白色沉淀生成;气泡产生;白色沉淀生成;
【反思拓展】如果猜想Ⅱ正确,要使废液中只含有氯化钙,正确的处理方法是加入过量的碳酸钙,剩余的碳酸钙可通过过滤的方法滤出,溶液中只剩下氯化钙;故填:碳酸钙;
点评 本题考查化学方程式的书写,溶液中含有溶质的验证,掌握物质相互反应的基本规律及验证和除杂的注意事项是解答问题的关键.


科目:初中化学 来源: 题型:选择题
| A. | BaCl2、NaOH、Na2CO3、过滤、HCl | B. | BaCl2、Na2CO3、NaOH、过滤、HCl | ||
| C. | NaOH、BaCl2、Na2CO3、过滤、HCl | D. | Na2CO3、BaCl2、NaOH、过滤、HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
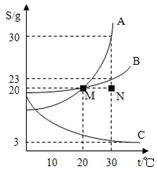 如图是A、B、C三种物质在水中的溶解度曲线,根据图回答:
如图是A、B、C三种物质在水中的溶解度曲线,根据图回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化钛中含有3个原子 | |
| B. | 萘胺中C、H、N的原子个数比为10:9:1 | |
| C. | 二氧化钛和萘胺都是有机物 | |
| D. | 这种试纸是一种新型化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
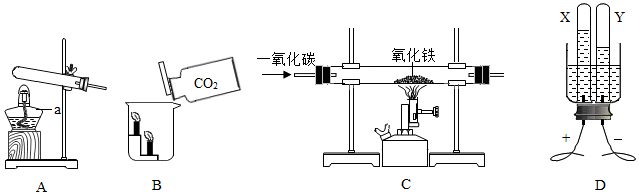
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X中一定含有碳、氢元素,可能含有氧元素 | |
| B. | X可能是氧化物 | |
| C. | 反应中生成物二氧化碳与水的质量比为44:18 | |
| D. | X的相对分子质量为46 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
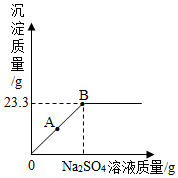 (1)A点时,溶液的溶质有氯化钠和氯化钡.
(1)A点时,溶液的溶质有氯化钠和氯化钡.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
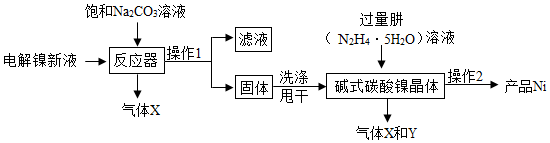
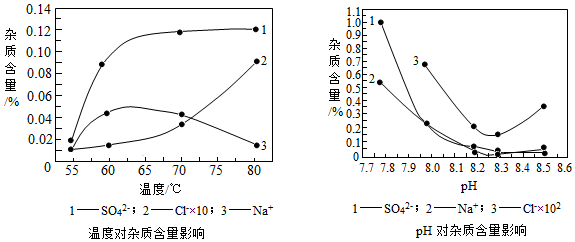
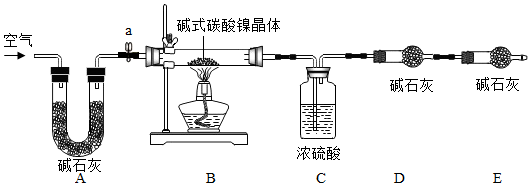
| 装置C/g | 装置D/g | 装置E/g | |
| 加热前 | 200.00 | 180.00 | 180.00 |
| 加热后 | 201.08 | 180.44 | 180.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com