
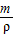 =
=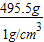 =495.5mL.
=495.5mL.

科目:初中化学 来源: 题型:阅读理解
 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
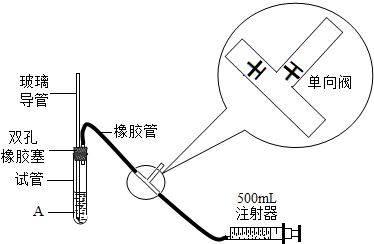
| S02最高浓度限值(单位mg?m-3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
| 组 别 | 第一小组(实验室) | 第二小组(教室) |
| 抽气次数 | 110 | 150 |
| 空气中S02的含量(单位:mg?m-3) |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:江苏省模拟题 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com