
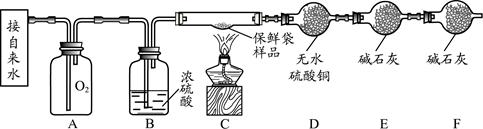


科目:初中化学 来源:不详 题型:填空题
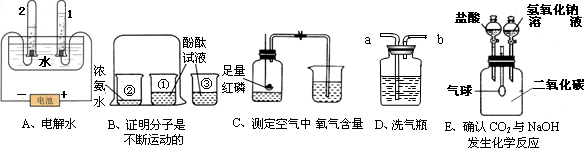
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
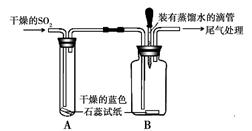
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.溶液中一定含FeCl2,固体一定含铜 |
| B.溶液中一定含FeCl2,固体一定是铁和铜 |
| C.溶液中一定含FeCl3,固体一定是铁和铜 |
| D.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
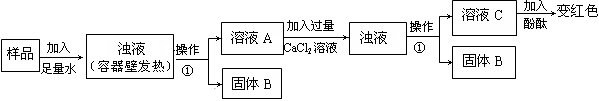
| A.样品中加水后容器壁发热,说明样品中一定含有CaO |
| B.样品加足量水后仍有固体,说明样品中一定含有CaCO3 |
| C.溶液A加入CaCl2溶液后产生固体,说明样品中一定含有Na2CO3 |
| D.溶液C加入酚酞变红,说明样品中一定含有NaOH |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ | 25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| Ⅰ | 1.2g | | |
| Ⅱ | 1.2g | CuO 0.5g | |
| Ⅲ | 1.2g | MnO2 0.5g | |

| | 气体发生装置内物质的总质量 |
| 反应前 | 35.6g |
| 反应后 | 34.8g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 物质名称 | 化学式 | 常温时的状态 |
| 丁烷 | C4H10 | 气 |
| 戊烷 | C5H12 | 液(油状) |
| 癸烷 | C10H22 | 液(油状) |
| 十八烷 | C18H38 | 固 |
| 二十四烷 | C24H50 | 固 |
| 序号 | 实验目的 | 实验操作 | 实验现象 |
| I | 探究哪一层火焰的温度最高 | 点燃蜡烛,把一根火柴梗平放在蜡烛的火焰中,约1s后取出观察 | |
| Ⅱ | 探究焰心中参与燃烧的物质的成分 | 点燃一根较粗的蜡烛,取一根一端为尖嘴的玻璃导管,一端伸入火焰的焰心处,然后在尖嘴一端导管口用火柴点燃 | 导管口处出现火焰 |
| III | 继续探究焰心中参与燃烧的物质的成分 | 点燃一根蜡烛,用一把带有手柄的小刀,将刀尖伸入火焰中最暗的部分,即焰心处,一段时间后取出,冷却,观察刀尖处的现象 | 冷却至室温后,刀尖处有油状液体和固体物质 |
| IV | | 用镊子夹住一片白瓷片,将瓷片伸入火焰中最明亮的部分,即内焰处,观察现象 | 白瓷片表面迅速变黑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com