
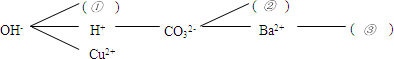


科目:初中化学 来源: 题型:

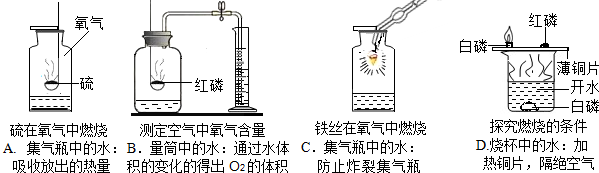
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:| 实验序号 | H2O2溶液 浓度% |
H2O2溶液 体积/mL |
温度/℃ | MnO2的 用量/g |
收集氧气的 体积/mL |
反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 实验序号 | H2O2溶液浓度% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 加热 |
| 加热 |
| 实验序号 | H2O2溶液 浓度% |
H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com