
【题目】重庆一中化学兴趣小组的同学用下图所示实验验证质量守恒定律,请你参与其中。
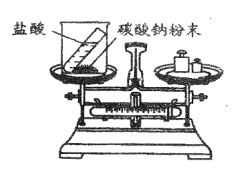
(1)请完善该反应的化学方程式:Na2CO3+ HCl= NaCl + H2O + CO2 ________,若碳酸钠粉末和盐酸恰好完全反应,则烧杯内溶液中所含的微粒有_____________(填微粒符号)。
(2)该实验中,大家进行了两次称量,有四组同学分别得到下列数据,其中有问题的数据是_________(填序号),该反应________(填“遵循”或“不遵循”)质量守恒定律。
① | ② | ③ | ④ | |
反应前称量/g | 75.6 | 73.8 | 74.6 | 76.5 |
反应后称量/g | 75.6 | 70.6 | 71.8 | 77.6 |
(3)为到达验证质量守恒定律的目的,下列改进方法一定可行的是___________(填序号)。

A.将实验试剂换为铁粉和硫酸铜溶液
B.将实验试剂换为二氧化锰和双氧水
C.将天平左盘装置改为如图①所示装置
D.将天平左盘装置改为如图②所示装置
(4)根据该实验得出结论,同学们试剂了如下图所示实验。
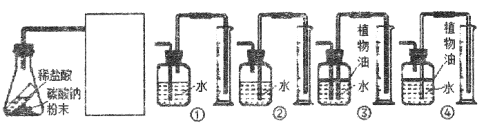
已知二氧化碳能溶于水,则方框内应选择装置_________(填序号)。若反应前锥形瓶内物质总质量为Mg,反应完全后锥形瓶内物质总质量为mg,收集到水的体积为Vml,水的密度为ρ1g/mL,二氧化碳的密度为ρ2g/mL,则可得到的等式是___________(选用含以上字母的式子表示)。
【答案】Na2CO3 + 2HCl ====2NaCl + H2O + CO2↑ Na+、Cl-、H2O ①④ 遵循 ACD ④ M-m=ρ2V
【解析】
(1)根据化学方程书写方法和氯化钠在水中电离进行分析解答;
(2)根据实验现象结合质量守恒定律进行分析;
(3)根据实验装置和试剂间反应生成物进行分析判定;
(4)根据二氧化碳的性质和质量守恒定律进行分析解答。
(1)该反应的化学方程式没有配平,没有标注符号,完善后的化学方程式是:Na2CO3 + 2HCl =2NaCl + H2O + CO2↑;若碳酸钠粉末和盐酸恰好完全反应,则烧杯内溶液中的溶质是氯化钠,溶剂是水,氯化钠在水中能电离出氯离子和钠离子,烧杯内溶液中所含的微粒有Na+、Cl-、H2O;
(2)在该实验中,碳酸钠与盐酸反应后生成二氧化碳逸出,反应后的质量应减小,所以有问题的数据是①④,所有的化学反应都遵循质量守恒定律,所以该反应遵循质量守恒定律;
(3)A、铁与硫酸铜反应生成硫酸亚铁和铜,属于化学反应,能将参加反应的物质质量和生成的物质质量,全部计算在内。将实验试剂换为铁粉和硫酸铜溶液能达到验证质量守恒定律的目的,故A正确;B、双氧水在二氧化锰作用下分解生成水和氧气,氧气逸出,将实验试剂换为二氧化锰和双氧水不能达到验证质量守恒定律的目的,故B错误;C、将天平左盘装置改为如图①所示装置,生成的二氧化碳不能逸出,能达到验证质量守恒定律的目的,故C错误;D、将天平左盘装置改为如图②所示装置,生成的二氧化碳被足量的澄清石灰水吸收不能逸出,能达到验证质量守恒定律的目的,故D正确。故选ACD;
(4)根据题意,方框内应的装置是收集二氧化碳并测量二氧化碳的体积,二氧化碳的密度小于水,二氧化碳能溶于水并与水反应,收集时可用植物油将水与二氧化碳隔离,方框内应选择装置是④;根据装置可知,排出水的体积等于二氧化碳的体积,所以生成二氧化碳的质量=ρ2V,根据质量守恒定律可得到的等式是M-m=ρ2V。


科目:初中化学 来源: 题型:
【题目】常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为 80%,则另 两种气体不可能是( )
A. H2和CO B. H2和C2H2 C. C2H2和C2H4 D. CO和C2H4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
(1)下图A、B、C三个实验用于验证质量守恒定律,
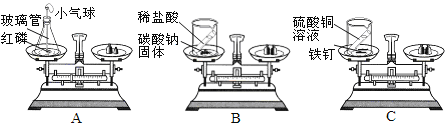
图A中小气球的作用是_________,图C中反应的化学方程式为__________
(2)分别实验后,发现图B不能达到实验目的,原因是___________。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
X的值为______________ ,容器内发生反应的基本类型是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)用化学符号表示:
①硅原子______,②氮分子______,③氧离子______,④铵根________,
⑤氧化铝中铝元素显+3价__________,⑥含氧量最高的氧化物__________。
(2)化学世界千变万化,请写出下列反应的文字表达式:
①加热碳酸氢铵固体___________,②石蜡在空气中燃烧________,③铁丝在空气中燃烧________。
以上反应中属于化合反应的有____(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是几种粒子的结构示意图,请回答下列问题。
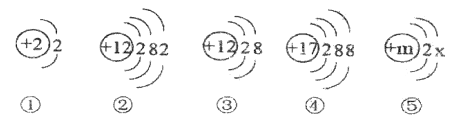
(1)①和②的化学性质______________(填“相似”或“不相似”)。
(2)一定属于同种元素的是________(填序号),由③④构成的物质的化学式___________
(3)若m=x+1,则⑤的化学符号是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气中氧气含量测定的再认识。




【经典赏析】拉瓦锡用定量的方法研究了空气的成分(装置如图1),通过该实验拉瓦锡得出了空气是由氧气和____________(填物质名称)组成的,其中氧气约占空气总体积的1/5。
【实验回顾】
(1)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),兴趣小组用该方法测出的氧气含量常常远低于1/5。其原因可能是:装置漏气;红磷量不足,装置内氧气有剩余;______ ;
(2)由于红磷在空气中点燃后才放入集气瓶内,实验缺陷:①测定结果不准确;②___________。
【提出问题】能否设计一套实验装置以解决上述缺陷?
【实验改进】
改进一:兴趣小组同学,设计了如图3所示装置:用一个100mL量筒倒扣在水中,使量筒内外液面均位于40mL处,量筒内浮着一个贴有银片的小木块,银片上放有足量白磷,将整套装置置于垫有________(填仪器名称)的铁架台的铁圈上加热。一会儿,白磷发生燃烧,量筒内液面上升,向烧杯内加水直至量筒内外液面相平,读出此时液面所对刻度。
(3)放白磷的平板用银做的原因是:银的___________(填物理性质)性好,易将白磷温度升高,且化学性质稳定;
(4)最终,液面大约位于量筒刻度_____mL处;白磷燃烧的文字表达式为___________。
改进二:兴趣小组同学又进行了大胆改进,设计图4(选用容积为40mL的的试管作反应容器,注射器活塞初始位置为20mL处,注射器空间为20mL,活塞与内壁摩擦力及连接管空间容积忽略不计)实验方案进行,收到了良好的效果。
(5)兴趣小组同学装配好图4装置,确认气密性良好后,将弹簧夹松开,直接给足量的红磷加热,红磷燃烧后,一开始活塞的运动方向为__________,反应完全并冷却后,注射器活塞最终将停留在约为_____mL(填整数)刻度处。
【交流反思】
(6)对照图2,改进后的实验装置有何优点__________(答一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,气体的制备是其中一种重要的实验。现有如下仪器供选。

(实验一)用大理石(或石灰石)和稀盐酸制取CO2。
(1)仪器A的名称是______,仪器F的名称是______。
(2)组装整套装置时,可选用图中的A、B、C、I、J、L、P和______。
(3)组装的装置在加入药品前要检查气密性,方法有多种,下列方法和现象能说明该装置不漏气的是___________(填字母序号填空)。
A.用弹簧夹夹紧橡胶管,向长颈漏斗中加水,长颈漏斗内形成稳定的水柱;
B.向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓拉注射器活塞,长颈漏斗下端冒气泡;
C.向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓推注射器活塞,长颈漏斗中液面上升;
D.将导管浸入水中,双手捂住锥形瓶外壁,观察到导管口没有气泡;
(4)实验室制取CO2气体的化学方程式为____,用向上排空法收集CO2气体验满的操作是____。
(5)选择气体的制取装置时,需要考虑反应物的状态、____和气体的性质。
(实验二)实验室制取O2并进行一系列探究。
〖探究1〗用氯酸钾、二氧化锰为原料制取并收集氧气
(1)该方法制取氧气的化学方程式为____;能用排水法收集氧气是因为氧气___;选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择上图中的________。
(2)某同学组装了发生装置如图1所示,错误是____,若要改正错误,需要操作的旋钮是____(填字母)。
(3)某小组经实验测定,排水法收集的氧气平均浓度为89.7%,向上排空气法收集的氧气平均浓度为79.7%,对比排水法和向上排空气法,________法收集的氧气更纯净,用向上排空气法收集到的氧气浓度只有80%左右的原因有_______(填字母编号)。
A.氧气的密度略大于空气的密度
B.加热氯酸钾和二氧化锰固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
(4)某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为______。
A.4% B.14.5% C.25.5% D.50%
〖探究2〗对H2O2分解的各种催化剂的催化效果进行定量对比探究
(小资料)海藻酸钠是一种天然高分子物质,在本实验中性质稳定。实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到如图的锥形瓶内压强随时间变化的曲线图。
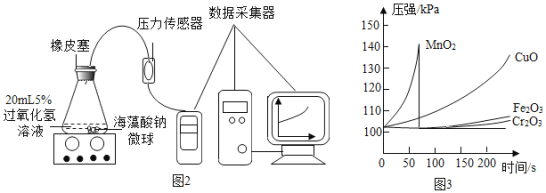
(1)用双氧水、二氧化锰为原料制取氧气的化学方程式为___,该反应属于___反应(填基本反应类型)。
(2)每次实验时,海藻酸钠微球数应相同的原因_____。
(3)用含MnO2的海藻酸钠微球进行实验,60 s左右时压强瞬间回落,其原因是________。
(4)从实验曲线看,催化效果较好、反应温和的催化剂是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2015年10月,我国科学家屠呦呦获得诺贝尔生理学奖,理由是她发现了青蒿素,青蒿素的化学式为C15H22O5 ,是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命,求:
(1)青蒿素相对分子质量为_______;
(2)青蒿素中碳、氢、氧三种元素的质量比______;
(3)青蒿素中碳元素的质量分数_______;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某品牌补铁剂的标签。富马酸亚铁的化学式为C4H2FeO4,请回答:

(1)富马酸亚铁分子中C、H、Fe、O原子个数比为__________。
(2)富马酸亚铁的相对分子质量为__________。
(3)若每次服用1包该补铁剂,摄入铁元素的质量为__________mg(计算结果取整数)(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com