
【题目】(7分)菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
加入H2S04溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。.
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)
(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境的影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了l.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
【答案】(1)4.4g
(2)菱镁矿中镁元素的质量分数为24%。
(3)9.8%
(4)作图见下图曲线
【解析】
试题分析:(1)碳酸镁可与稀硫酸反应生成二氧化碳气体,氢氧化钠可与二氧化碳气体反应。所以氢氧化钠溶液增重的质量即为反应生成的二氧化碳的质量。由于氢氧化钠溶液增重的质量最大值为4.4g 。所以生成CO2的质量为4.4g。
(2)根据题意可知:已知量为生成二氧化碳的质量;未知量为菱镁矿中镁元素的质量分数。解题思路:可根据二氧化碳与碳酸镁在反应体系中的质量关系,求出碳酸镁的质量。再进一步可计算出菱镁矿中镁元素的质量分数。具体过程如下:
解:设菱镁矿中MgCO3的质量为x。
MgCO3+H2SO4=MgSO4+H2O+CO2↑
84 44
x 4.4g
84∶44=x∶4.4g
x = 8.4g
菱镁矿中镁元素的质量分数=[(8.4g×24/84)÷10g]×100%24%
答:该菱镁矿中镁元素的质量分数为24%。
(3)根据表格中的数据可知:第一、二两次中的硫酸完全反应,所以可根据第一、二两次中二氧化碳的质量计算出参加反应的硫酸的质量,进一步计算出硫酸的质量分数。具体过程如下:
解:设所用H2SO4溶液的溶质的质量分数为y
MgCO3+H2SO4=MgSO4+H2O+CO2↑
98 44
100gy 4.4g
98:44=100gy:4.4g
y = 9.8%
所用H2SO4溶液的溶质的质量分数为9.8%。
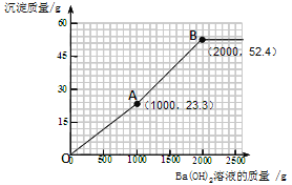
(4)加入的氢氧化钡可先与过量的稀硫酸反应。由于过量的稀硫酸中硫酸的质量为(200g—100g)×9.8%= 9.8g。根据反应的化学方程式可计算出:可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g。所以图像中的第一个折点的坐标为(1000,23.3 )。
再加入的氢氧化钡与硫酸镁反应。根据反应的化学方程式可计算出:硫酸镁的质量为12 g,可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g,生成氢氧化镁沉淀的质量为5.8 g。因此图像中的第二个折点所用的氢氧化钡溶液的质量为1000 g+1000 g=2000 g。同时沉淀的质量为23.3 g+23.3 g+5.8 g=52.4 g。所以图像中的第二个折点的坐标为(2000,52.4)。
再加入氢氧化钡时,不再产生沉淀。可根据规律进行描点和画图为:


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:
【题目】(7分)宏观与微观的桥梁——粒子结构模型
微观粒子看不见、摸不着,化学家通过模型来说明他们心目中粒子的“模样”,揭示物质的微观结构特点,解释微观结构与宏观现象之间的因果关系,模型化的方法是化学科学重要的思想工具。试回答下列问题:
(1)原子的结构
一百多年来,化学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,并通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
①下图两种模型是汤姆森和卢瑟福分别于1897年和1911年提出的,其中(填代号,下同)
是由汤姆森提出的。

②下列关于原子结构理论的学说中,汤姆森的观点是(填代号,下同) ,卢瑟福的观点是 。
A.原子是不可分的 B.原子是可分的
C. 原子呈球形 D. 在球体内充斥着正电荷,电子镶嵌其中
E.带正电荷的原子核居于原子的中心
F.带正电荷的原子核很小,但集中了原子的大部分质量
G.电子带负电
H.电子在原子核外很大的空间内高速运动
(2)离子的结构
在初中化学中,离子的结构可以用离子的结构示意图来表示。在下图中:
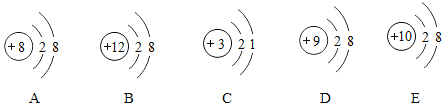
属于阳离子的是(填代号,下同) ,属于阳离子的是 。
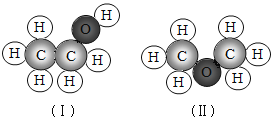
(3)分子的结构
下图中(Ⅰ)和(Ⅱ)分别是两个分子的微观结构模型。你认为它们所代表的物质的化学式是否相同? ,二者是不是同一种物质? 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】掌握化学用语是学好化学的基础,请用相应的化学符号和数字按下列要求填空.
(1)硫元素 (2)正二价的铜元素
(3)两个氢离子 (4)氨气分子 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)氨水(NH3·H2O)也是常见的碱,是由NH3溶于水形成的溶液。氨水很不稳定,容易放出有刺激性气味的NH3。根据所学知识回答:
(1)NH3·H2O在水溶液中解离出来的离子有 。
(2)打开装有氨水的试剂瓶后闻到刺激性气味,说明分子 。
(3)写出NH3·H2O与稀H2SO4反应的化学方程式 。
(4)将一片有酚酞的干燥纸条和一片有酚酞的湿润纸条分别放入两瓶干燥的NH3中,现象是:
。
![]() (5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)向20g锌样品(杂质不溶于水,也不溶于酸)中加入100g质量分数为19.6%的稀硫酸,恰好完全反应。试计算该锌样品中锌的质量分数(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中不正确的是 ( )
A. 碱性溶液不一定是碱的溶液
B. 酸溶液一定是酸性溶液
C. 能使紫色石蕊试液变红的溶液一定是酸溶液
D. 紫色石蕊试液或者酚酞试液加入蒸馏水中均不变色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com