
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造机器、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15 mL稀盐酸分三次加入到5 g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
| 第一次 | 第二次 | 第三次 |
加入稀盐酸的体积(mL) | 5 | 5 | 5 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:(1)m=________________;
(2)此黄铜样品中锌的质量分数是多少?
(1)0.04??? (2)65%
【解析】从实验数据可以发现:第一、二次每当加入5 mL稀盐酸时酸都完全反应,生成氢气的质量为0.04 g,即m=0.04,当第三次加入5 mL稀盐酸后,5 g黄铜中的锌已经完全反应,就只能生成0.02 g氢气了,则5 g黄铜中锌完全与稀盐酸反应生成氢气的质量为m(H2)=0.04 g+0.04 g+0.02 g=0.10 g,根据锌与盐酸反应的化学方程式,由氢气的质量可以求出锌的质量,从而求出锌的质量分数。
(2)设此黄铜样品中锌的质量为x。
Zn+2HCl=ZnCl2+H2↑
65???????????? 2
x???????????? 0.10 g
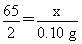 ?? x=3.25 g
?? x=3.25 g
则此黄铜样品中锌的质量分数为 ×100%=65%。
×100%=65%。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源:轻巧夺冠优化训练·人教版·九年级化学下 题型:038
我国约在南北朝时就开时冶铸黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取
10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气0.1g.试求:(1)该黄铜样品中铜的质量分数;
(2)原稀硫酸中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源:1+1轻巧夺冠·优化训练 化学 九年级下册 (人教版) 银版 人教版 银版 题型:038
我国约在南北朝时就开时冶铸黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取10 g黄铜加入到50 g稀硫酸中,恰好完全反应,产生氢气0.1 g.试求:
(1)该黄铜样品中铜的质量分数;
(2)原稀硫酸中溶质的质量分数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com