碳和氧化铜混合物20克,高温加热后氧化铜完全反应,剩余固体15.6克,求碳与氧化铜的质量比.
【答案】
分析:此题可分为两种情况讨论①氧化铜过量,则剩余的固体是氧化铜和铜的质量,则据固体质量的减少量就是生成气体的质量,根据二氧化碳的质量算出反应的氧化铜、碳和生成的铜的质量,即可得两物质的质量比;②碳粉过量,则可知剩余固体是铜,利用氧化铜的化学式可求氧化铜的质量,进而可得两物质的质量之比.
解答:解:(1)氧化铜过量:根据质量守恒定律可知生成二氧化碳的质量为20g-15.6g=4.4g;
设生成4.4g二氧化碳,参加反应的氧化铜质量为x,需要参加反应的碳的质量为y,生成铜的质量为z则:
2CuO+C
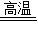
2Cu+CO
2↑
160 12 128 44
x y z 4.4g

解得x=16g y=1.2g z=12.8g
所以残余固体中铜是12.8g,没有参加反应的氧化铜的质量为:15.6g-12.8g=2.8g,则混合物中氧化铜的质量为:16g+2.8g=18.8g,碳:20g-18.8g=1.2g.碳和氧化铜两者的质量之比是1.2g:18.8g=3:47;
(2)假设碳过量:则剩余的固体全部是铜,即15.6g铜,故氧化铜的质量为
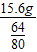
=19.5g,所以碳的质量是20g-19.5g=0.5g;氧化铜和碳的质量之比是19.5g:0.5g=39:1;
答:碳与氧化铜的质量比是3:47或1:39;
点评:本题主要考查学生充分考虑实验现象的认识和运用化学方程式进行计算的能力,本题容易出错的地方是氧化铜和碳过量问题,不要忽略到底是谁过量.

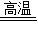 2Cu+CO2↑
2Cu+CO2↑
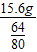 =19.5g,所以碳的质量是20g-19.5g=0.5g;氧化铜和碳的质量之比是19.5g:0.5g=39:1;
=19.5g,所以碳的质量是20g-19.5g=0.5g;氧化铜和碳的质量之比是19.5g:0.5g=39:1;
