


科目:初中化学 来源: 题型:
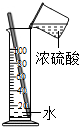
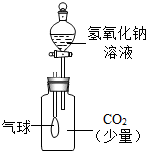
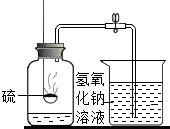
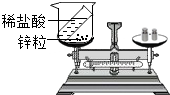
 9、下图是某兴趣小组设计的一套实验装置,装置足以维持实验过程中小白鼠的生命活动,瓶口密封.装置气密性良好.经数小时后,这样会导致试剂瓶中的气体越来越少,压强不断减小下列哪种情况?(忽略水蒸气和温度变化对实验结果的影响)( )
9、下图是某兴趣小组设计的一套实验装置,装置足以维持实验过程中小白鼠的生命活动,瓶口密封.装置气密性良好.经数小时后,这样会导致试剂瓶中的气体越来越少,压强不断减小下列哪种情况?(忽略水蒸气和温度变化对实验结果的影响)( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com