


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:初中化学 来源: 题型:阅读理解
 20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
| 盐溶液 | NaCl | Na2CO3 | BaCl2 | CuSO4 | CaCl2 |
| pH | =7 | >7 | =7 | <7 | =7 |
| 实验步骤 | 实验现象 | 解释、结论 |
| 取少量溶液,向溶液中加入过量的 氯化钡溶液(或氯化钙溶液) 氯化钡溶液(或氯化钙溶液) ,过滤. |
现象: 白色沉淀 白色沉淀 |
反应的化学方程式为 BaCl2+Na2CO3═BaCO3↓+2NaCl (或CaCl2+Na2CO3═CaCO3↓+2NaCl) BaCl2+Na2CO3═BaCO3↓+2NaCl (或CaCl2+Na2CO3═CaCO3↓+2NaCl) |
| 取上述实验所得滤液,向其中滴加酚酞试剂. | 现象: 红色 红色 |
综合分析,得出结论: 溶质是氢氧化钠和碳酸钠. |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
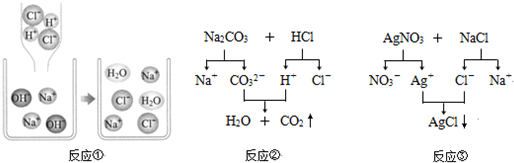
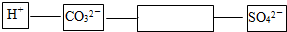
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com