
| A. | 长期饮用蒸馏水对身体有益 | |
| B. | 水是一种重要的溶剂 | |
| C. | 生活中可采用过滤的方法将硬水软水 | |
| D. | 过滤后的海水是纯净物 |
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
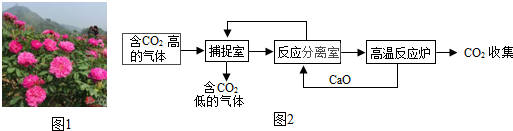
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂及操作方法 |
| A | KNO3溶液 | KCl溶液 | 加入适量AgNO3溶液,过滤 |
| B | KClO3 | MnO2 | 加入足量水溶解,过滤、蒸发、结晶 |
| C | CO2 | CO | 将混合气体通过足量灼热的氧化铜 |
| D | 铁粉 | 铜粉 | 加入足量稀盐酸,溶解、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊 | 猜想2 成立 |
| ②在上述反应后的试管中加少量品红溶液 | 品红溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com