
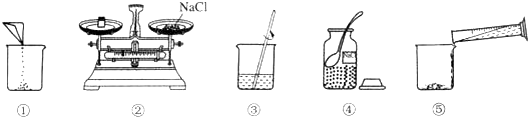
分析 (1)食盐的溶解度受温度影响变化不大,利用海水晒盐,是利用了蒸发结晶的原理,据此进行分析解答.
(2)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答.
解答 解:(1)目前从海水中提取食盐的方法主要是利用海水晒盐,食盐的溶解度受温度的影响较小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,利用了蒸发结晶的原理.
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:④③②①.
故答案为:(1)C;(2)B.
点评 本题难度较大,考查了粗盐提纯的原理与离子的除杂,除去多种杂质离子时,要考除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步骤 | 实验现象 | 分析和结论 |
| 1.在蒸馏水中加入几滴石蕊溶液. | 液体呈紫色. | 蒸馏水中有水分子,它不能使石蕊溶液变红色. |
| 2.在硫酸钠溶液中加入几滴石蕊溶液. | 液体呈紫色. | 硫酸钠溶液和稀硫酸中含有的相同硫酸根离子,它不能使石蕊溶液变红色. |
| 3.在稀盐酸中加入几滴石蕊溶液. | 溶液呈红色. | 稀硫酸和稀硫酸中含有的相同氢离子离子,它能使石蕊溶液变红色. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食盐 | B. | 食醋 | C. | 酱油 | D. | 香油 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
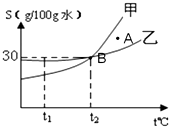 如图是甲、乙两种物质的溶解度曲线.
如图是甲、乙两种物质的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com