
科目: 来源:2014届中考化学总复习基础讲练:第十单元《酸和碱》(新人教版) 人教版 题型:058
某研究性学习小组对中和反应进行探究,请你参与实验:
实验1:证明酸与碱发生了反应.
稀盐酸与NaOH溶液混合没有明显现象,小丽同学按图甲进行实验,证明了盐酸与NaOH溶液发生化学反应,她依据的实验现象是________.

实验2:证明酸与碱反应有水生成.
小明同学取变色硅胶固体(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行图乙所示的三个实验.
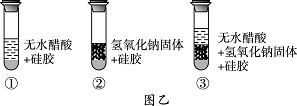
(1)观察发现实验①、②的硅胶不变色,这两个实验的实验目的是________.
(2)加入试剂后,要迅速塞紧橡胶塞的原因________.
(3)能证明酸与碱反应有水生成的现象是________.
实验3:测量酸与碱反应过程的pH、温度变化
取一定量的稀盐酸,逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的pH、温度变化曲线(如图丙).
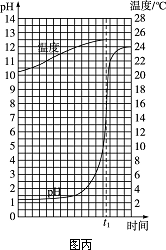
(1)0~t1时,溶液的酸碱性变化情况是________.
(2)由图丙分析,酸与碱发生反应的依据是________,酸与碱的反应是________(填“吸热”或“放热”)反应.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十二单元《化学与生活》(新人教版) 人教版 题型:058
由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题.某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料样品在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量.
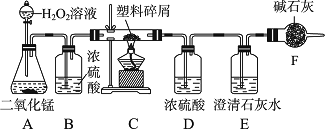
(1)仪器A中所发生反应的化学方程式为________.
(2)仪器B的作用是________.
(3)仪器E中的现象是________.
(4)若仪器C的玻璃管中放入的塑料样品质量为W g,塑料样品充分燃烧后,若仪器D增重a g,则W g该塑料样品中含氢元素的质量为________ g.(计算结果可为分数形式)
(5)如果不用B装置,则推算出的氢元素质量________(填“偏大”“偏小”或“不变”).
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十二单元《化学与生活》(新人教版) 人教版 题型:058
超市中的许多食物用保鲜膜包装后出售.保鲜膜为什么可以“保鲜”呢?
[设计实验]在A、B、C三只相同的玻璃杯中,分别注入等体积的蒸馏水,并在各玻璃杯外壁标明刻度,如图所示放置一周.
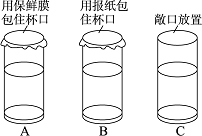
[实验现象]一周后发现:A杯中的水量几乎不变;而C杯中的水量减少较多;B杯中的现象是________.
[解释]请用分子的知识解释C杯中水量减少的原因:________.
[结论]保鲜膜除了可以阻止食物中水分流失,还能隔绝________,防止食物腐败.
[反思]保鲜膜虽然能延长食品的保鲜期,但大量使用后丢弃会造成________,所以要控制使用.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数.先称取该混合物样品20 g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100 g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
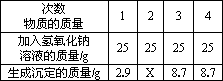
(1)上表中X的数值为________.
(2)计算原固体混合物样品中氯化镁的质量分数是多少?
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80 g溶质质量分数为30%的氢氧化钠溶液配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
某化学兴趣小组,在一次查阅“关于如何治疗人体胃酸过多”的资料后,决定利用实验室相关仪器(高温消毒)自制小苏打水(NaHCO3水溶液),用来缓解胃酸过多的症状.具体配制步骤(经医生建议)如下:
第一步:准确称量8.4 g食品级小苏打粉末;第二步:将第一步所称粉末配成100 g溶液;第三步:将第二步所得溶液取出10 g,再加水配制成100 g溶液即得到治疗胃酸过多的小苏打水(密度为1.0 g·mL-1).
请回答下列问题:
(1)第一步用到的主要仪器是________;第二步使用的玻璃仪器有________(至少写两种).
(2)第三步配制所得的小苏打水中NaHCO3的质量分数是________.
(3)胃酸过多者在医生的指导下,每次喝50 mL第三步配制所得的小苏打水,一天两次,则一天可反应掉胃液中的HCl________g.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
小煜通过学习知道:Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应.
[产生疑问]NaHCO3溶液也能与石灰水发生反应吗?如果能反应,生成物可能是什么?
[进行实验]小煜将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐.此白色沉淀是________,证明NaHCO3溶液与Ca(OH)2溶液也能发生反应.为了进一步了解生成的含钠化合物有什么,继续探究:
[作出猜想]①只有NaOH
②有Na2CO3和NaOH
③________
[实验设计]步骤1:取少量上述实验后的上层清液于试管中,再滴加足量的CaCl2溶液(中性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有________;
步骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为________,整个实验过程中无气泡产生,由此可知猜想②成立.
[拓展提高]若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为________.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
食醋、食盐和纯碱都是日常生活中常用的物质.食醋中通常含有3%~5%的乙酸,乙酸俗称醋酸,是一种无色液体.食盐和纯碱都是白色固体.
(1)在用食醋拌凉菜时,往往可以闻到醋香,这说明醋酸具有________性.食醋不宜存放在含铁等金属的容器内,原因是________.请写一个你熟悉的酸与金属反应的化学方程式________.
(2)用食醋可以鉴别食盐和纯碱.请简要写出实验步骤和现象:________.
(3)纯碱的水溶液能使紫色石蕊溶液变蓝,说明其水溶液显________性,而在酸、碱、盐三类化合物中,纯碱属于________类.纯碱还能与许多化合物反应,请写一个你知道的纯碱与碱反应的化学方程式________.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
“‘复分解反应发生条件’的活动与探究”用到H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液.某校化学兴趣小组的同学对实验后的废液进行了探究.取废液少许,测得其pH为12.
[提出问题]废液中除含OH-外,还含有哪些离子呢?
[理论分析]废液是由四种盐混合而成的.这四种盐电离出的8种离子(H+、SO![]() 、Ba2+、NO
、Ba2+、NO![]() 、Na+、OH-、K+、CO
、Na+、OH-、K+、CO![]() )之间会相互发生反应.废液的pH为12,显碱性,所以一定不存在一种离子是________;有三种离子在任何条件下都会存在,它们是NO
)之间会相互发生反应.废液的pH为12,显碱性,所以一定不存在一种离子是________;有三种离子在任何条件下都会存在,它们是NO![]() 、K+和________.
、K+和________.
[猜想与假设]甲同学:另外,可能还含有SO![]() 、CO
、CO![]()
乙同学:另外,可能还含有Ba2+
丙同学:另外,可能还含有Ba2+、SO![]() 、CO
、CO![]()
以上甲、乙、丙三位同学的假设中,________同学的假设一定不成立,原因是________.
[实验验证]选择其中一种可能成立的假设,设计实验进行验证.我选择________同学的假设,实验方案如下:
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下:
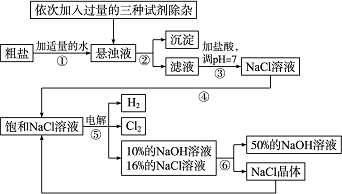
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途.下列关于氢氧化钠的描述中,错误的是________.
A.能去除油污,可作厨房清洁剂
B.易溶于水,溶解时放出大量的热
C.水溶液能使石蕊溶液变红
D.可用作某些气体的干燥剂
(2)操作②的名称是________,操作④的名称是________.
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之________(填“前”或“后”)加入.有同学提出用________溶液代替BaCl2溶液可达到同样的目的.
(4)电解饱和NaCl溶液的化学方程式是________.
(5)该流程中可以循环利用的物质是________.
查看答案和解析>>
科目: 来源:2014届中考化学总复习基础讲练:第十一单元《盐,化肥》(新人教版) 人教版 题型:058
下图是“ΔΔ牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):

[查阅资料]
(1)酒石酸是一种易溶解于水的固体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2;
(3)Na2CO3受热不分解.
[提出问题]
NaHCO3在发酵粉加水或加热时如何产生CO2?
[猜想]
甲:……
乙:酒石酸与NaHCO3在溶液中反应产生CO2.
丙:NaHCO3加热产生CO2.
[实验探究]
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是________.
小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是________.
(2)小英同学为探究猜想丙设计了如图所示的实验装置:
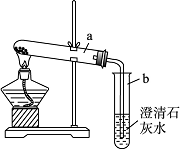
小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊.b试管中反应的化学方程式为________.
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是________.
[小结]
NaHCO3在发酵粉中产生CO2的条件是________;
NaHCO3受热发生变化的化学方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com