
科目: 来源: 题型:038
磁铁矿(主要成分是Fe3O4)是冶炼生铁的常用原料。若测得某磁铁矿石中铁元素的质量分数为49%。(假设杂质不含铁元素)请回答下列问题:
(1)四氧化三铁中铁元素与氧元素的质量比为?(2)若要得到纯铁28 t,从理论上计算需要这种磁铁矿石多少吨?
查看答案和解析>>
科目: 来源: 题型:038
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:
|
实验次数 |
稀盐酸的用量(g) |
剩余固体的质量(g) |
|
1 |
10 |
18.375 |
|
2 |
10 |
16.750 |
|
3 |
10 |
15.125 |
|
4 |
10 |
13.500 |
|
5 |
10 |
13.500 |
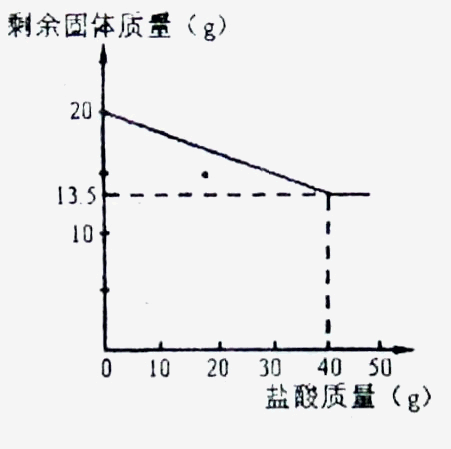
⑴ 求铜锌合金中锌的质量分数:
⑵ 计算稀盐酸中溶质的质量分数。
⑶ 当合金中的锌与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为多少?
查看答案和解析>>
科目: 来源: 题型:038
中和反应是放热反应。取10mL溶质质量分数为10%的NaOH溶液(密度1.10g/mL)置于烧杯中(并滴入3滴酚酞),向烧杯中逐量加入HCl。随HCl滴入,烧杯中溶液颜色逐渐变浅,当加入10mLHCl时,恰好变无色;而且烧杯中溶液温度与加入HCl体积之间关系如图所示(已知:HCl+NaOH=NaCl+H2O)。
(1)10mL、10%的氢氧化钠溶液含NaOH ______ g。
(2)为何加入10mL盐酸时,烧杯中溶液的温度最高?
答: 。
(3)所加盐酸(密度 1.05 g/mL)的溶质质量分数是多少?
查看答案和解析>>
科目: 来源: 题型:038
(2008年盐城市)一化学兴趣小组对某生铁样品中铁的质量分数进行探究。请按要求完成下列探究报告。
[实验目的]
测定某生铁样品中单质铁的质量分数。
[资料支撑]
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素。碳在生铁中以两种形态存在,一种是游离碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
[实验方案]
生铁样品与过量的稀硫酸反应,测定反应前后可称量物质的质量差。
[实验过程]
(1)取一只烧杯,称得其质量为70.4g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为102.4g;
(2)向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
(3)静置,称量。称得烧杯和剩余物质的总质量为348.7g。
[数据处理]
计算该生铁样品中单质铁的质量分数:____________
[交流讨论]
(1)实验称量时称量物应放在托盘天平的______盘(选填“左”或“右”);
(2)实验过程中稀硫酸要过量的原因是______________________________;
(3)经质检部门精确测定,该样品中铁元素的总含量为95.2%。假设没有与硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量分数为__________________。
查看答案和解析>>
科目: 来源: 题型:038
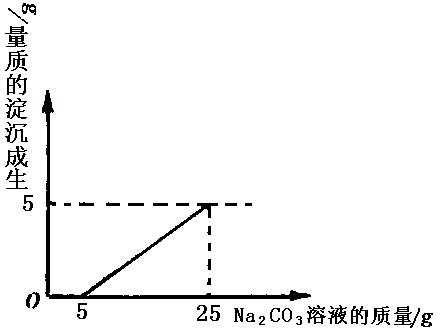
(08山东临沂)(6分)刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有______________________;
(2)计算Na2CO3溶液中溶质的质量分数。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:038
下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)欲配制14.3%的稀盐酸1000g,需要用这种盐酸多少毫升?
(2)13g锌与足量的稀盐酸充分反应,理论上可制得氢气多少克?

查看答案和解析>>
科目: 来源: 题型:038
某中学化学课外活动小组的同学在实验室测定一批生理盐水中NaCl的质量分数。取该生理盐水130克,向其中加入足量的AgN03溶液完全反应后,生成氯化银沉淀2.87克。计算该生理盐水中NaCl的质量分数。
查看答案和解析>>
科目: 来源: 题型:038
环保部门对某工厂的废水进行分析,结果表明:废水中含少量硫酸。取一定量废水用2%的氢氧化钠溶液中和(已知废水中的其它成分不与氢氧化钠反应),至PH等于7 时,消耗氢氧化钠溶液质量为40g,同时测得反应后溶液质量为138g。请计算该工厂排放的废水中硫酸的质量分数。
查看答案和解析>>
科目: 来源: 题型:038
阳光牌小包装撏蜒跫翑成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌撏蜒跫翑的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌撏蜒跫翑一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0 g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。求:
(1)8.0 g滤渣中Fe和Fe2O3两种物质的总质量。
(2)该撏蜒跫翑在未变质时,Fe粉和活性炭的质量之比。
(3)该撏蜒跫翑的变质程度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com