
科目: 来源: 题型:038
某中学化学课外活动小组的同学在实验室测定一批生理盐水中NaCl的质量分数。取该生理盐水130克,向其中加入足量的AgN03溶液完全反应后,生成氯化银沉淀2.87克。计算该生理盐水中NaCl的质量分数。
查看答案和解析>>
科目: 来源: 题型:038
某化工厂生产的纯碱产品中常含有少量氯化钠,工厂的化验员对每批产品进行检测,标出各种成份后才能投放市场。某厂化验员取取样品44g于烧杯中加水将其溶解,然后分几次逐滴加入溶质质量分数为20%的稀盐酸,并不断搅拌,称量,将得到的有关数据记录如下(注:加盐酸时首先发生反应是:Na2CO3 + HCl = NaHCO3 + NaCl ,然后是NaHCO3 + HCl = NaCl + CO2↑+ H2O)

请你根据题给信息和表中数据,回答下列问题:
(1)加入 g稀盐酸开始产生二氧化碳,最多产生二氧化碳 g。
(2)在下列图中标出产生二氧化碳质量随滴加盐酸质量的变化曲线。(要在图上注明二氧化碳、盐酸的相关质量)
(3)计算出44g样品中各成份的质量。

查看答案和解析>>
科目: 来源: 题型:038
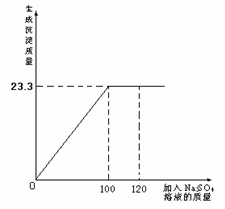
将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(P水 = 1g/cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(1)生成沉淀的质量是多少?
(2)所得溶液中溶质的质量分数为多少?
查看答案和解析>>
科目: 来源: 题型:038
质检人员对某品牌发酵粉中NaHCO3的含量进行检测。取20.0g发酵粉,向其中加入足量的盐酸,得到3.30g的二氧化碳(发酵粉中其它成分不与盐酸反应)。计算此品牌发酵粉中碳酸氢钠的质量分数。
查看答案和解析>>
科目: 来源: 题型:038
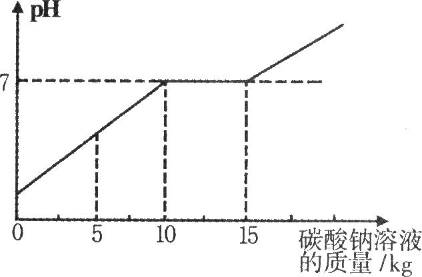
在化学实验技能考试做完摱?趸?嫉闹迫『托灾蕯实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:
(1)通过右图可知,当碳酸钠溶液质量加到 kg时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)此时所得溶液能否用于该校生物兴趣小组的小麦选种(选种液要求氯化钠的溶质质量分数在10%一20%之间)?请通过计算回答。
查看答案和解析>>
科目: 来源: 题型:038
星期天,小强的妈妈要焙制面包,叫小强取商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问:

回到学校,他取出从家里带来的一小包纯碱样品进行实验:准确称取5.5 g样品放入烧杯中,在滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25 g,得溶液质量为28.3 g(杂质溶于水且与盐酸不反应)。求:
(1)生成CO2的质量是 ;
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:038
环保部门对某工厂的废水进行分析,结果表明:废水中含少量硫酸。取一定量废水用2%的氢氧化钠溶液中和(已知废水中的其它成分不与氢氧化钠反应),至PH等于7 时,消耗氢氧化钠溶液质量为40g,同时测得反应后溶液质量为138g。请计算该工厂排放的废水中硫酸的质量分数。
查看答案和解析>>
科目: 来源: 题型:038
阳光牌小包装撏蜒跫翑成分为Fe粉、活性炭及少量NaCl、水。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究使用过的阳光牌撏蜒跫翑的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤(1)取食品包装袋中的阳光牌撏蜒跫翑一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤(2)取步骤(1)中的滤渣8.0 g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体1.2 g。
步骤(3)取步骤(2)中的滤液,加入足量的NaOH溶液,得到的固体经洗涤后转移到坩埚中,充分加热、冷却、称量,得到8.0g Fe2O3(注:滤液中的Fe元素已全部转化为Fe2O3)。求:
(1)8.0 g滤渣中Fe和Fe2O3两种物质的总质量。
(2)该撏蜒跫翑在未变质时,Fe粉和活性炭的质量之比。
(3)该撏蜒跫翑的变质程度。
查看答案和解析>>
科目: 来源: 题型:038
50g Ca(NO3)2溶液与50g K2CO3溶液混合后,恰好完全反应。经过滤、干燥、称量,得到5g沉淀。反应的化学方程式是:K2CO3+Ca(NO3)2==CaCO3↓+2KNO3。请计算:
(1)参加反应的K2CO3的质量。
(2)过滤后所得溶液的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com