
科目: 来源:2012年江苏省苏州市中考化学试卷 题型:022
富含淀粉的谷物、甘薯等可以酿酒.在酿酒过程中淀粉在酶的作用下转化为葡萄糖,葡萄糖发酵为酒精.香甜的酒酿就是利用该原理.用酒曲酶(俗称酒药)制作的.家庭一般制作酒酿的简单流程图如下:(注:有机反应化学方程式可用箭号表示)
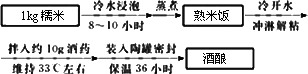
(1)配平化学方程式:(C6H10O5)n(淀粉)+________H2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
(2)如温度、水分等因素控制不当,易导致乳酸量过多而味偏酸,请完成该反应的化学方程式:C6H12O6![]() 2________(乳酸).
2________(乳酸).
(3)成熟的酒酿放置时间越长酒味越浓,因为更多的葡萄糖在酒化酶作用下发酵分解为酒精(C2H5OH)和二氧化碳,写出该反应的化学方程式________![]() ________.
________.
(4)若用1 kg大米酿米酒,假设其中有0.81 kg的淀粉全部转化为酒精,则理论上可酿制含酒精质量分数为10%的米酒________kg,(提示:由淀粉转化为酒精的关系式为(C6H10O5)n~2nC2H5OH).
查看答案和解析>>
科目: 来源:2012年江苏省苏州市中考化学试卷 题型:022
请阅读以下摘自今年的《苏州日报》,与化学关系密切的信息,并填空.
[资讯1]据市环境监测站专家分析:5月4日至7日,由于阳光灿烂,臭氧(O3)也出来“作怪”,连续四天的日平均浓度也均超标.臭氧在常温常压下是淡蓝色气体,稳定性极差,可自行分解为氧气.臭氧在空气中达到一定浓度可刺激呼吸道.大气中臭氧浓度超标的原因是:在静风条件下强烈的阳光就成为氮氧化物的催化剂,从而推高了臭氧浓度,形成污染.
(1)臭氧“自行分解”的化学方程式为________;若氮氧化物假定为二氧化氮,强光条件下促使其分解产生了O3和N2.则该反应的化学方程式为________.
[资讯2]吴江某公司研发的一层看似普通的白色薄膜,却有超高防水透气、阻燃、抗菌和耐腐蚀的神奇功能…这种膜的专业术语叫聚四氟乙烯纳米微孔薄膜,由聚四氟乙烯树脂经特殊设备和工艺制作而成,该树脂是一种超高分子量材料.
(2)制作这种薄膜的聚四氟乙烯树脂[(CF2CF2)n]的相对分子质量为1×108,其n值等于________.碳元素的质量分数为________.
查看答案和解析>>
科目: 来源:2012年江苏省苏州市中考化学试卷 题型:022
写出下列反应的化学方程式并填空.
(1)碳在过量氧气中充分燃烧:________该反应属于________(选填“放热”或“吸热”)反应.
(2)锌和稀硫酸反应:________;反应类型是________
(3)盐酸与碳酸氢按反应:________;明显的现象是________
(4)实验室加热高锰酸钾制取氧气:________在发生装置的试管口放一团棉花的作用是________
(5)用熟石灰和硫酸铜溶液制备波尔多液:________反应类型是________.
查看答案和解析>>
科目: 来源:浙江省台州市2012年中考化学试题 题型:022
2011年9月,中国中医研究员屠呦呦因发现并提取出青蒿素(化学式为C15H22O5)而获得有着诺贝尔奖风向标之美誉的拉斯克奖.她发现的青蒿素用以治疗疟疾,挽救了数百万患者的生命.
(1)下列关于青蒿素的叙述正确的是________.
①青蒿素属于有机化合物
②青蒿素由C、H、0三种元素组成
③青蒿素由15个碳原子、22个氢原子和5个氧原子构成
④青蒿素中C、H、O三种元素的质量比为15:22:5
⑤青蒿素的相对分子质量为282
(2)从控制传染病流行的三个环节考虑,“给疟疾忠者服用青蒿素”属于________.
(3)19世纪以来,奎宁和氯喹先后作为抗击疟疾的特效药,但后来由于疟原虫产生了抗药性,治疗效果越来越差,这是药物对疟原虫进行定向选择的结果,也是生物对环境的一种________现象.
查看答案和解析>>
科目: 来源:浙江省台州市2012年中考化学试题 题型:022
酶的催化效率不仅与温度、酸碱度有关,还与离子种类有关,如氯离子(Cl-)能提高唾液淀粉酶的催化效率,铜离子(Cu2+)能降低唾液淀粉酶的催化效率,钠离子(Na+)对唾液淀粉酶的催化效率无影响.为了进一步探究硫酸根离子(SO42-)能否提高唾液淀粉酶的催化效率,小柯进行了如下实验:
第1步:取2支洁净的试管,按下表中从左到右的顺序将药品加入到相应的试管中.
第3步:将2支试管同时进行37℃的水浴加热,观察并记录现象.
(1)小柯的实验还不能确定硫酸根离子(SO42-)能否提高唾液淀粉酶的催化效率,需作如何改进?答:________.
(2)如果硫酸根离子(SO42-)能提高唾液淀粉酶的催化效率,那么小柯改进实验后的现象应是________.
(3)第3步操作中,另有一同学小妍把2支试管同时分别握在左、右手心里,也达到了相同的实验效果.请分析小妍这种做法的优点:________.
查看答案和解析>>
科目: 来源:山东省泰安市2012年中考化学试题 题型:022
下图是一瓶医用注射盐水标签的部分内容.完成下列填空:

(1)氯化钠中钠、氯元素的质量比是________;
(2)氯化钠中钠元素的质量分数是________(精确到0.1%);
(3)该瓶盐水能给病人提供氯化钠的质量是________g;
(4)该瓶盐水能给病人提供钠元素的质量是________g(精确到0.1 g).
查看答案和解析>>
科目: 来源:山东省泰安市2012年中考化学试题 题型:022
2012年4月15日,央视《每周质量报告》报道:一些企业用皮革废料熬制工业明胶,在加工过程中添加重铬酸钾,在加热条件下重铬酸钾分解,反应的化学方程式为:4K2Cr2O7![]() 4K2CrO4+2X+3O2↑,工业明胶制造药用胶囊,导致胶囊重金属铬超标.铬是一种重金属元素,能对肝、肾等内脏器官和DNA造成损伤.在通常情况下,铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;在加热时,能与浓硫酸反应生成硫酸铬(其中铬元素化合价为+3价),同时还生成一种大气污染物和一种常见的液体.
4K2CrO4+2X+3O2↑,工业明胶制造药用胶囊,导致胶囊重金属铬超标.铬是一种重金属元素,能对肝、肾等内脏器官和DNA造成损伤.在通常情况下,铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;在加热时,能与浓硫酸反应生成硫酸铬(其中铬元素化合价为+3价),同时还生成一种大气污染物和一种常见的液体.
回答下列问题:
(1)K2CrO4中铬元素的化合价是________;K2Cr2O7分解生成X的化学式为________;
(2)归纳铬单质的物理性质________;
(3)铬单质与浓硫酸反应的化学方程式为________;
(4)食品安全事件不断被报道,如:三聚氰胺、染色馒头等,在广大消费者中造成较大影响.面对事件要科学分析,正确判断.你认为下列认识缺乏科学性的是________(填字母序号).
A.使用了化学添加剂的食品对人体都有危害
B.三聚氰胺、苏丹红、甲醛都是化工产品,食品安全事件都是化学惹得祸
C.物质对人体的影响与摄入量有关,量变才能引起质变
D.要合理膳食,使人体中各种常量、微量元素保持收支平衡
查看答案和解析>>
科目: 来源:江苏省泰州市2012年中考化学试题 题型:022
下图是用绿色粉末A制取红色金属H的两种流程,其中白色固体F是一种常见的建筑材料,固体乙是目前用途最广、产量最高的金属.
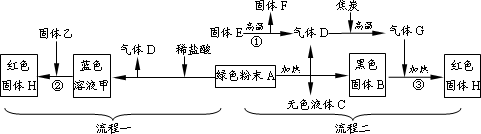
请回答下列问题:
(1)写出有关物质的化学式:B________;乙________.
(2)写出转化①的化学方程式________,F的其他用途有________.
(3)转化②的过程中生成红色固体H的化学方程式为________;如果在转化②中同时产生气体,则原因是(用化学方程式说明)________.
(4)转化③发生的反应方程式为________.
(5)如果在实验室中由物质A制取H,上述两种流程中,操作比较简便的是流程________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com