
科目: 来源:甘肃省兰州市2012年中考化学试题 题型:058
下列装置常用于实验室制取气体.根据给出的装置回答下列问题:
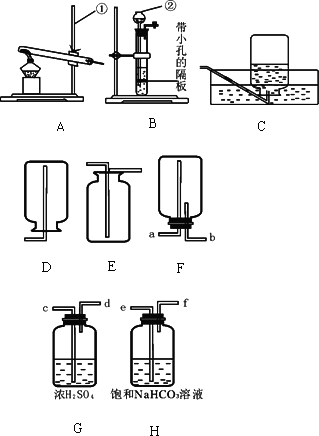
(1)指出编号仪器名称:①________;②________.
(2)实验室利用A装置制取氧气,反应原理用化学方程式表示为________.利用C装置收集氧气的最佳时刻是________.用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是________(用化学方程式表示).
(3)制取并收集二氧化碳应选择的装置是________(从A——E中选择),使用该套装置制取气体的突出优点是________,该反应原理用化学方程式表示为________.若改用F装置收集二氧化碳,则气体应从________端进入.制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,欲使个G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→________(用端口字母表示).
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的pH、________(填“>”、“<”或“=”)7,对该现象的合理解释为________(用化学方程式表示).
查看答案和解析>>
科目: 来源:甘肃省兰州市2012年中考化学试题 题型:058
下列是初中化学常见的四个实验,回答下列问题:
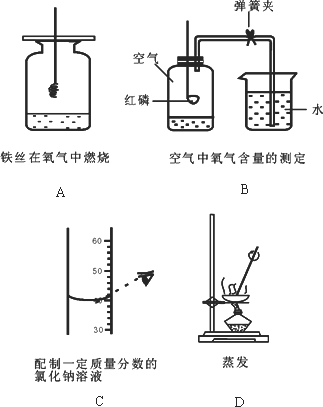
(1)A实验中集气瓶内预先装少量水的目的是________.
(2)B实验中导致实验结果偏小的原因是________(只写一个).
(3)C实验中该操作将导致所配溶液溶质质量分数________(填“偏大”、“偏小”或“不变”).
(4)D实验中待________时,应停止加热.
查看答案和解析>>
科目: 来源:甘肃省兰州市2012年中考化学试题 题型:058
2012年1月,广西河池宜州市境内龙江河发生了镉浓度超标事件.根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动.
查阅资料:
①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价
②水体中镉元素通常以氯化镉的形式存在
③氯化镉能溶于水,氢氧化镉难溶于水
(一)金属镉与铜、银活动性顺序的探究

实验结论:活动性顺序:镉>铜>银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为________.小敏认为该方案虽然有效,但有缺陷,原因是________.受小聪与小敏启发,你认为可以用________(写俗称)代替烧碱.
查看答案和解析>>
科目: 来源:湖南省衡阳市2012年中考化学试题 题型:058
某化学兴趣小组查阅资料得知:过氧化钠(Na2O2)是一种黄色粉末,常温下能与二氧化碳反应产生氧气,常用在潜水艇中作供氧剂.该小组同学将过氧化钠与二氧化碳反应后,发现除了生成氧气,还生成了一种白色固体.
[提出问题]该白色固体是什么?
[猜想]猜想a:碳酸钠
猜想b:碳酸氢钠
小周同学认为猜想b不成立,理由是反应物中没有________元素.
[实验]取少量生成的白色固体于试管中,加入________,产生气泡,再将生成的气体通入澄清石灰水中,石灰水变浑浊.
[结论]猜想a成立.
请写出过氧化钠与二氧化碳反应的化学方程式________.
[继续探究]过氧化钠能否与水反应?生成物是什么?
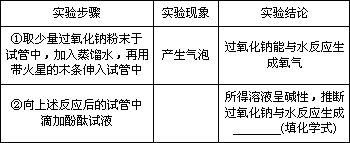
[交流与反思]由于过氧化钠常温下能与二氧化碳和水反应,所以保存过氧化钠一定要________.
查看答案和解析>>
科目: 来源:湖南省衡阳市2012年中考化学试题 题型:058
下面是实验室制取气体及气体性质试验装置图.请回答下列问题:
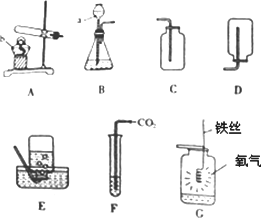
(1)写出图中有标号仪器的名称:a________;b________.
(2)实验室可用加热氯酸钾和二氧化锰的混合物来制取氧气,其反应的化学方程式为________.
(3)如图G,铁丝在氧气中剧烈燃烧,________,生成黑色固体,而瓶底预先放入少量水的目的是________.
(4)实验室制取并收集二氧化碳的装置应选用________(填序号);用图F所示装置来探究二氧化碳能否与水反应,测试管中的水里应加入的试剂是________.
查看答案和解析>>
科目: 来源:湖南省怀化市2012年中考化学试题 题型:058
以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
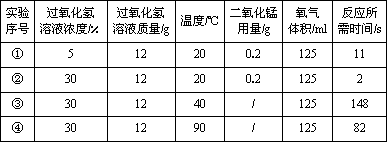
(1)通过实验①和②对比可知,化学反应快慢与________有关;
(2)通过对比实验________和________可知,化学反应快慢与温度的关系是________.
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是________.
(4)某实验室需配置450克5%的过氧化氢溶液,其操作为:往一定量30%的过氧化氢溶液中加入________克水,然后用________(填仪器名称)搅拌均匀.
查看答案和解析>>
科目: 来源:河南省2012年中考化学试题 题型:058
有一包白色粉末,其中含有CuSO4、BaCl2,NaOH,Na2CO3中的一种或几种.某化学小组为确定白色粉末的成分,进行了如下实验:
(Ⅰ)取一定量的白色粉末,加入足量水,震荡,得到无色透明溶液;
(Ⅱ)取少量(Ⅰ)的溶液,加入足量盐酸,有气泡产生.(提示:Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?可能含有什么物质?
(2)为确定可能含有的物质是否存在,还需要做什么实验?请写出简要的实验步骤.
查看答案和解析>>
科目: 来源:河南省2012年中考化学试题 题型:058
如图是实验室制取气体的装置.
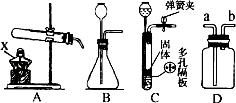
(1)仪器X的名称是________.
(2)写一个A装置制取O2的化学方程式________.
(3)B和C装置均可制取CO2,C装置的优点是可随时控制反应的发生和停止.若打开弹簧夹,固体与液体接触,反应便能发生,请简述使C装置中反应停止的原理________.
(4)若用D装置采取排水法收集O2,请简述操作步骤________.
查看答案和解析>>
科目: 来源:河北省2012年中考理综试题化学部分 题型:058
小红为大家做了一个“燃纸成铁”的趣味实验.将一张滤纸(组成元素为C、H、O)用FeCl3浓溶液润湿,在酒精灯上烘干后点燃,滤纸变黑、红热,最终生成黑褐色物质.小红告诉大家:黑褐色物质中含有铁单质.
[提出问题]黑褐色物质中真的含有铁单质吗?
[探究过程]
(1)小红先从反应物分析,因为________所以反应后可能生成铁单质.
(2)为获得实验证据,小红做了实验1.
实验1:将黑褐色物质放入稀盐酸中,发现有连续微小气泡产生.若黑褐色物质中含有铁单质,则反应的化学方程式为________.
(3)小明提出疑问:由反应物的组成分析,能与稀盐酸反应产生气泡的物质不一定是铁单质,还可能是________.
小红通过查阅资料得知,在高温条件下不可能生成此类物质.
(4)小明仍有疑问:实验1中产生的气泡也可能是滤纸碳化后吸附的空气.
为此,小红又做了实验1的对比实验:________观察到有微小气泡产生但很快停止.证明实验1中的连续气泡确实是由铁单质与稀盐酸反应产生的.
(5)为进一步证明黑褐色物质中有铁单质,小红又做了实验2.
实验2:将黑褐色物质放入________溶液中,观察到________.
[得出结论]通过以上探究,证明黑褐色物质中确实含有铁单质.
[拓展探究]请再用一种方法证明黑褐色物质中含有铁单质:________.
查看答案和解析>>
科目: 来源:江苏省连云港市2012年中考化学试题 题型:058
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
[资料获悉]铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.
[教师指导]铁被氧气氧化最终产物为红棕色的Fe2O3(其他产物忽略不计).
[探究目的]小组同学欲探究该“脱氧剂”是否已经失效(即单质铁是否已经完全被氧化),并测定各成分的质量分数,设计了以下探究实验.
[实验探究]
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
步骤2:称取10.00 g样品与一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为7.28 g.
步骤3:按如下装置,将得到的7.28 g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.15 g.

步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20 g.
[交流讨论]
(1)由步骤1得出的结论是________.
(2)步骤2目的是________,检验该滤液中溶质的方法是________.
(3)步骤3中仪器A的名称为________.
小明认为0.15 g差值即为H2的质量,并由此计算出样品中单质铁的质量为4.20 g.
小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是________.
(4)如果步骤4中滤渣没有经过洗涤,则称得的质量________1.20 g(填“>”或“=”或“<”)
[教师指导]样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和.
[学生实验]小红将步骤3的装置进行了改进,重新称取10.00 g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.14 g.
[数据处理]由于反应过程较复杂,小组同学在老师的帮助下,推算出与Fe2(SO4)3反应消耗铁的质量为0.56 g.
[请你参与]
(1)写出Fe2O3与稀硫酸反应的化学方程式.
(2)请根据以上数据,计算该样品中各成分的质量分数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com