
科目: 来源: 题型:探究题
(8分)随着人们对酒驾危害认识的加深,司法机关对于酒驾、醉驾的处罚将日趋加重。醉酒的原因是酒中含有的乙醇对人的神经系统有刺激作用。交警对呼气酒精检验的原理是:橙色的K2Cr2O7酸性溶液遇乙醇会迅速变成蓝绿色。
白酒是乙醇的水溶液,酒中的乙醇在微生物作用下能被氧化成乙酸。小刚家有一瓶密封存放的白酒,他想知道该白酒的组成情况,于是进行如下实验探究:
【提出问题】该白酒中的溶质主要有哪些?
【查阅资料】材料一:乙醇(C2H5OH),俗称酒精,易溶于水,水溶液呈中性。在加热条件下,可以把氧化铜还原为单质铜。
材料二:乙酸(CH3COOH),又名醋酸,易溶于水,具有酸的通性。
【提出猜想】猜想1:只有乙醇
猜想2:只有乙酸
猜想3:
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量白酒于试管中,滴入几滴橙色的K2Cr2O7酸性溶液 | | 猜想3成立 |
| ② | |
查看答案和解析>>
科目: 来源: 题型:探究题
(7分)实验室可以用草酸(H2C2O4)在浓硫酸的作用下来制取一氧化碳,反应原理为:
H2C2O4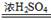 CO↑+ CO2↑+ H2O
CO↑+ CO2↑+ H2O
小明同学设计下图所示装置来制取一氧化碳,并验证一氧化碳的性质。 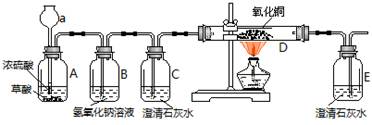
请回答下列问题:
(1)长颈漏斗a的漏斗颈没入液面下的目
的是 。
(2)B中氢氧化钠溶液的作用是 。
(3)C中澄清石灰水的作用是 。
(4)通过什么现象可以判断CO能与CuO反应? 。
(5)D中反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:探究题
同学们在学习碱的化学性质时,进行了如下图所示的实验。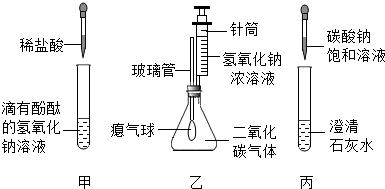
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称)。
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠;小红认为:只有氢氧化钙;小林认为:是氢氧化钠和碳酸钠
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | 小林的猜想正确。 |
| ② 。 | 小云的猜想正确。 | |
| ③没有白色沉淀,溶液呈红色。 | 小红的猜想正确。 |
查看答案和解析>>
科目: 来源: 题型:探究题
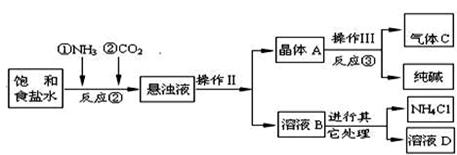
(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
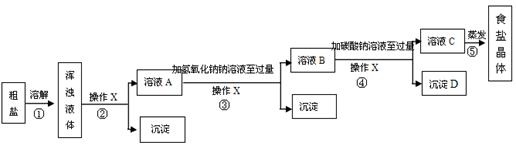
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
查看答案和解析>>
科目: 来源: 题型:探究题
(10分)在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)
进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究。
Ⅰ.定性探究:
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,
②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加 | | 猜想①正确。碳酸钠与其反应的化学方程式为 |
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| | “猜想二”成立 | |
| | “猜想三”成立 |
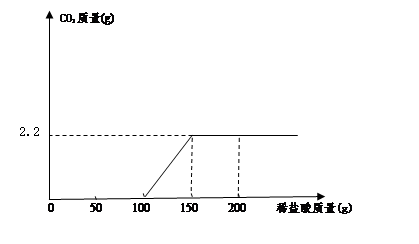
查看答案和解析>>
科目: 来源: 题型:探究题
(6分)某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。请设计三种实验方案,用三种不同类别的物质检验烧杯中的溶液是否含有氯化氢,并根据实验过程完成下表需填写的内容。
| | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取烧杯中溶液少许于试管中,向其中滴加2至3滴紫色石蕊试液 | | 溶液显酸性(含有H+);溶质中有氯化氢。 |
| 方案二 | | 有气泡产生 | |
| 方案三 | | |
查看答案和解析>>
科目: 来源: 题型:探究题
(7分)红枣包装中常使用一种“504双吸剂”,其成分为铁粉、生石灰等。实验小组同学对一包使用过的“504双吸剂”进行了如下探究。
【提出问题】使用后固体的成分是什么?
【查阅资料】Fe + 2FeCl3 === 3FeCl2
【进行猜想】固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【进行实验】
甲同学的实验记录:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放入试管中,滴加一定量的 ,用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 | 试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有 , 不含Fe2O3。 |
| 取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液。 | 试管底部有不溶物, 。 | 固体中含有氧化钙和氢氧化钙。 |

查看答案和解析>>
科目: 来源: 题型:探究题
(9分)某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。
【查阅资料】氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。
| | 实验操作 | 实验现象 | 实验结论 |
| 甲同学 | 取烧杯中溶液少许于试管中,向其中滴加______ | 现象:溶液变为红色 | 溶液显酸性(含有H+);溶质中有氯化氢。 |
| 乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象:_________________________ 反应的化学方程式是: _______________________________ | |
| 丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量石灰石 | 现象:_________________________ 反应的化学方程式是:____________ |
查看答案和解析>>
科目: 来源: 题型:探究题
(9分)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后过滤得到的滤液的成分进行探究。请你一同探究并回答下列问题:
【提出问题】 滤液中的溶质是什么物质?
【猜想假设】 猜想Ⅰ:只含有NaOH;
猜想Ⅱ:可能含有 ;
猜想Ⅲ:可能含有NaOH Na2CO3;
猜想Ⅳ:可能含有NaOH Ca(OH)2 Na2CO3;
【分析讨论】经分析和讨论,全体同学认为猜想 肯定不合理,理由是 。
【实验设计】现实验室仅提供稀盐酸、氯化钙溶液、酚酞溶液和必要的仪器,设计一个实验来验证猜想Ⅲ是正确的。请在空格内写出实验操作、预计现象和结论。通过查阅资料知道:①氯化钙溶液呈中性;②碳酸钠(俗名纯碱)的水溶液呈碱性。
| 实验操作 | 预期现象和结论 |
| | |
| | |
查看答案和解析>>
科目: 来源: 题型:探究题
氢氧化钠固体如果密封不严,会发生变质,为探究学校实验室内某瓶氢氧化钠固体
变质情况,化学兴趣小组进行了如下实验:
(1)取少量该瓶固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,该小组确定氢氧化钠已经变质,那么该小组同学加入的无色溶液可能是
(2)为了继续探究氢氧化钠的变质程度,该兴趣小组同学取了10g样品,溶于足量水配成溶液,然后向溶液中滴加含足量氢氧化钙的溶液,恰好得到1g沉淀和500g溶液,请计算出最后所得溶液中溶质的质量分数为多少?(计算结果精确至0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com