
科目: 来源: 题型:探究题
(5分)化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
| 实验装置 | 实验步骤及操作 | 实验现象 |
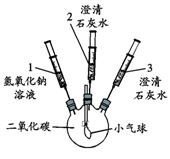 | ① 将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
| ② 向外拉注射器2的活塞 | 无明显现象 | |
| ③ 将注射器3中的溶液推入瓶中 | 瓶中液体变浑浊,气球无明显变化 | |
| ④ 向外拉注射器2的活塞 | 无明显现象 |
查看答案和解析>>
科目: 来源: 题型:探究题
(10分)二十一世纪是海洋开发与利用的世纪,某市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与探究:
问题一、海水制镁过程中如何富集镁离子?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳。
乙:高温加热蒸发海水后,加入石灰乳。
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为___________的设想最为经济合理(选填“甲”、“乙”或“丙”)。
问题二、粗盐提纯过程中如何除去可溶性杂质?
【查阅资料】
粗盐中含有硫酸钠、氯化钙等可溶性杂质。
【设计实验】
提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是_____①________;再加过量的____②______,除尽杂质阳离子;滤去沉淀,向滤液中加入__③_____,将溶液的pH调为7,即得到精盐水。
问题三、海水“制碱” 的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行
了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中只含有氢氧化钠;
丙的猜想:样品中含有碳酸钠和氢氧化钠。
他们做出上述三种猜想的科学依据是________________________________。
【实验、记录与分析】
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全 溶解,再加入________________ | _____________________ | 乙的猜想 不成立 |
| 2 | 取步骤1反应后的溶液于试管中 ___________________________ | 无明显现象 | 只有甲的 猜想成立 |
查看答案和解析>>
科目: 来源: 题型:探究题
实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。
(1)根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
(2) 已知 Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下图:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |
查看答案和解析>>
科目: 来源: 题型:探究题
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示 。
实验探究1:甲同学的方案(见下表)。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有 , 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 | | 固体中一定含有CaCO3 |

查看答案和解析>>
科目: 来源: 题型:探究题
(7分)资料表明:在不同温度下,CO可将Fe2O3还原为Fe、Fe3O4中的一种或两种。为探究温度对该反应产物的影响,进行如下实验。
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
| | FeCl2溶液 | FeCl3溶液 |
| 加入Fe | 无明显变化 | 溶液变成浅绿色 |
| 加试剂A | 无明显变化 | 溶液变成红色 |
| 实验操作 | 实验现象 | 结论与解释 |
| ①取少量的黑色固体于试管中,滴加适量的______ ②向步骤①所得的溶液中,滴加试剂A | 甲组: 固体溶解,无气泡冒出 加试剂A后,溶液变成红色 | 黑色固体的成分是______ 甲组用CO还原Fe2O3反应的化学方程式是______ |
| 乙组: 固体溶解, 加试剂A后,溶液颜色无明显变化 | 黑色固体的成分是Fe |
 (2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是 。
(2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是 。查看答案和解析>>
科目: 来源: 题型:探究题
6分)实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
【资料:Na2CO3+CaCl2 =" 2NaCl" + CaCO3↓】
回答下列问题:
(1)样品加水放热的原因是 (用化学方程式表示)。
(2)②中反应的化学方程式是 。
(3)③中的实验现象是 。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是 。
依据实验现象及数据判断,原样品的成分是 。
查看答案和解析>>
科目: 来源: 题型:探究题
(7分)课外小组同学在实验室发现了一瓶标签残缺的无色液体(下图),想通过探究确定其成分,以便重新利用。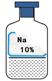
【初步分析】操作不规范可能造成标签破损,能造成标签破损的不当操作有 (写一点)。根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 20oC溶解度/g | 36 | 109 | 21.5 | 9.6 |
| 水溶液的pH | 7 | 14 | 11 | 9 |


查看答案和解析>>
科目: 来源: 题型:探究题
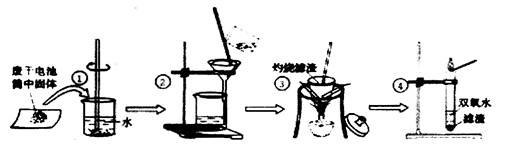
(7分)目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用
技术。右图为普通电池(锌锰电池)示意图,请你根据图示
分析回答:
(1)废旧电池内含有的一种有机物名称是 ____。
(2)小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶
液,并检验氯化铵中的铵根离子。设计了如下实验,
请回答:
实验①玻璃棒的作用是
实验②过滤后,滤液仍然浑浊,则造成浑浊的原因可能 (填编号)
| A.滤纸破损 | B.过滤过程中滤液的液面超过了滤纸的边缘 |
| C.烧杯不干净 | D.滤液C中的物质相互反应 |
查看答案和解析>>
科目: 来源: 题型:探究题
(22分)著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
| 实验步骤 | 实验现象 | 实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 | | 滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 | 产生无色 无味气体。 | 滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 | 产生白色沉淀。 | 滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 | 产生白色沉淀。 | 反应的化学方程式: 。 |
查看答案和解析>>
科目: 来源: 题型:探究题
(5分)初中化学常见白色固体甲由三种元素组成。将10g甲与100 mL水混合,得混合物A,再将A与足量稀盐酸反应得混合物B。
(1)若A中有白色沉淀,加入稀盐酸后沉淀溶解,且有气泡放出,则甲是 。
(2)若A中有白色沉淀,加入稀盐酸后沉淀溶解,且无气泡放出,则甲是 。
(3)若A为无色溶液,将其分成两等分,第一份加入稀盐酸后有气体放出,第二份加入(2)中的甲2g,有沉淀生成,此时所得溶液中的溶质是 。第一份和第二份溶液中发生反应的化学方程式分别是 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com