
科目: 来源: 题型:计算题
(10分)实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察到溶液由红色变为无色时,停止滴液。再次称量锥形瓶,质量为51.0g
请解答下列问题:
(1)所取烧碱溶液的质量 = g。(注:滴人酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量= g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。(列出计算过程)
(4)问题讨论:小亮做同样的实验得到的结果与小军的结果有差异。于是小亮测自己实验后锥形瓶内溶液的pH,pH =6.2,则小亮的结果比小军的 (选填“偏大”或“偏小”或“无影响”),原因是 。
查看答案和解析>>
科目: 来源: 题型:计算题
100克某浓度的硫酸恰好与13克的锌完全起反应,请计算:
(1)生成氢气的质量(结果精确到0.1g).
(2)将(1)的结果标在图中;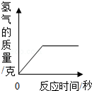
(3)反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
查看答案和解析>>
科目: 来源: 题型:计算题
黄铜是铜和锌的合金,某化学兴趣小组的同学在测定黄铜中铜的含量时,取黄铜样品40g,放入烧杯中,向其中加入200g稀硫酸,恰好完全反应,反应后烧杯中剩余物的总质量为239.6g,请计算
①产生氢气的质量是 ;
②参与反应的稀硫酸的质量是 ;
③黄铜中铜的质量分数
查看答案和解析>>
科目: 来源: 题型:计算题
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)
查看答案和解析>>
科目: 来源: 题型:计算题
小红同学在网店花了200元买了一个10g重的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究:在实验室用足量的稀硫酸分多次与手镯充分反应,实验结果如下表:
| 稀硫酸/g | 10 | 10 | 10 | 10 | 10 |
| 剩余固体质量/g | 8.7 | 7.4 | 6.1 | 4.8 | 4.8 |
查看答案和解析>>
科目: 来源: 题型:计算题
重铬酸钾(K2Cr2O7Mr=294,铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但+6价格有很强的毒性易污染环境,使用后,须用绿矾,(FeSO4?7H2O,Mr=278)将其变成毒性+3价格才能做后续处理.反应原理是:6FeSO4?7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
查看答案和解析>>
科目: 来源: 题型:计算题
“氯碱工业”是我国目前化学工业的重要支柱之一,它的主要原理是电解饱和食盐水,其化学方程式为xNaCl+2H2O xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
请分析并计算回答:
(1)运用质量守恒定律可知上述反应中x= .
(2)通过计算,上述过程中同时产生H2的质量为 g.
(3)计算电解后剩余溶液中NaC1的质量分数(写出详细的计算过程,结果精确到0.1%).
查看答案和解析>>
科目: 来源: 题型:计算题
向50g Na2CO3溶液中逐滴加入一定溶质质量分数的CaCl2溶液。实验过程中,生成沉淀质量与加入CaCl2溶液的质量关系如右图所示,试计算:
(1)恰好完全反应时,生成沉淀的质量为______________g。
(2)计算恰好完全反应时,所得溶液中溶质的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com