
科目: 来源: 题型:探究题
(18分)工业烧碱(NaOH)具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某化学学习小组同学围绕工业烧碱展开系列研究。
探究一:工业烧碱中是否含有碳酸钠
【查阅资料】碳酸钠和氯化钙能发生复分解反应。
小红指出可选用下列实验药品来探究:稀盐酸、酚酞试液、CaCl2溶液。
(1)小组同学经过讨论后,一致认为使用 药品不能达到探究目的,理由是 。
(2)请根据选用的实验药品完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量工业烧碱样品配成溶液后,滴加过量 | | 工业烧碱中含有碳酸钠,产生实验现象的化学方程式: 。 |

查看答案和解析>>
科目: 来源: 题型:探究题
(7分)某工业生产上规定空气中二氧化硫的允许排放量不得超过0.02mg/m3。某研究性学习小组利用“碘量法”测定某化工厂附近空气中的二氧化硫的含量,请你参与并协助他们完成相关学习任务。
【查阅资料】淀粉遇碘(I2)变蓝,遇氢碘酸(HI)不变色。氢碘酸为无色液体。
【测定原理】
碘溶液吸收SO2的化学反应原理是:SO2 + I2 + 2H2O==X + 2HI。X的化学式为 。
【测定步骤】
取配制好的碘(I2)溶液5.00mL(含I2的质量为6.35×10-4 mg)于下述装置中的反应容器内,并滴加2-3滴无色淀粉溶液。
利用上述装置到指定的测试点抽气,每拉动1次注射器抽气100mL,并注入碘溶液中,直到反应恰好完全为止,记录抽气的次数。抽气时应进行的操作是 。实验中表明恰好完全反应的现象
是
(3)换到不同地点再重复实验4次(每次所取碘溶液相同)。这样做的目的是 。
每次实验的抽气次数记录 见下表。
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 抽气次数 | 42 | 38 | 36 | 44 | 40 |
| 二氧化硫的含量 | 是否超标 |
| | |

查看答案和解析>>
科目: 来源: 题型:探究题
(7分)老师从实验室带来了7瓶不同的无色溶液(如下图所示),其中3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。根据查阅药品记录表可知,3、4、5、7号溶液分别是NaOH溶液、Na2CO3溶液、石灰水、CaCl2溶液中的一种。在老师的指导下,化学小组同学进行了下述实验。
(已知: Na2CO3溶液与CaCl2溶液能发生复分解反应)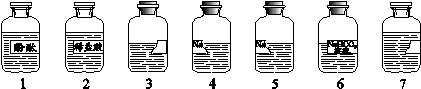
(1)分别取3、4、5、7号溶液于4支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”)。由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称)。
(2)分别取4号、5号溶液于两支试管中,加入足量的2号溶液,发现均有气泡产生,
小组同学利用上述试剂,经过下述实验最终确定了两份溶液的成分。
| 实验操作及现象 | 实验结论 |
| | 4号溶液是Na2CO3溶液,5号溶液是变质的NaOH溶液。 |
查看答案和解析>>
科目: 来源: 题型:探究题
(8分)某化学学习小组在化学药品柜中发现一瓶保管不当,标签模糊不清的无色溶液,(如图)且实验员告诉小组成员该溶液显碱性;已知这瓶溶液是以下四瓶溶液中的其中一种:H2SO4溶液、NaOH溶液、FeCl 3溶液、Na2CO3溶液。小组成员小强和小红同学很感兴趣,决定对其成分进行探究(提示:碳酸钠溶液显碱性)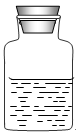
(1)小强和小红根据上述信息判断,该溶液不可能是 溶液和 溶液;
只可能是其他两种溶液中的一种。
(2)为了进一步确定该溶液是何种溶液,请你帮小强和小红设计实验方案,叙述
实验操作、预期现象与结论。
(实验室提供必要的实验仪器,限选以下试剂:氯化钡溶液、锌粒、澄清石灰水、食盐水、稀盐酸)
| 实验操作 | 预期现象与结论 |
| | |
查看答案和解析>>
科目: 来源: 题型:探究题
(8分)小强同学用三支试管,分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液进行相关实验探究。
步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,说明Na2CO3溶液显 性;
步骤2:小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;白色沉淀为 (写化学式)
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含有________。(选填字母):
A.稀盐酸 B.澄清石灰水 C.碳酸钠溶液
[实验猜想] 步骤3所得滤液中溶质可能为:①NaCl Na2CO3;
②NaCl CaCl2和NaOH;
③NaCl Na2CO3和NaOH; ④…
[实验验证](提示:CaCl2溶液显中性)
| 实验操作 | 实验现象 | 实验结论 | 有关化学方程式 |
| 取少量滤液于试管中,加入足量CaCl2溶液 | | 猜想③成立 | |
查看答案和解析>>
科目: 来源: 题型:探究题
实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的NaOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含NaOH; 假设2:含NaOH和Na2CO3; 假设3:只含Na2CO3
(1)取少量样品于试管中,加入足量稀盐酸,观察到 ,说明假设1不成立,假设2或假设3成立。
(2)进一步探究的过程如下: 
①“操作1”的名称是 ,其中要用到玻璃棒,其作用是 。
②加入足量CaCl2溶液的作用是 。
③加酚酞检验“溶液B”的现象是 。
查看答案和解析>>
科目: 来源: 题型:探究题
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到烧杯内的废液变浑浊,过滤后,小红等几位同学对滤液的成分又进行了探究。
(1)指出有标号仪器的名称:_______。
(2)实验探究:
【猜想】 小红认为:只含氢氧化钠;
小明认为:
含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:含有氢氧化钠和碳酸钠;
还有可能是 (你的猜想)。
【讨论】①三位同学的猜想,你认为是否有不合理,理由是 。 。
②小红的猜想是滤液中只含氢氧化钠,他的这种猜想的推测思路是:
。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, | | 你的猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
查看答案和解析>>
科目: 来源: 题型:探究题
(7分)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种。为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙。
写出上述操作中可能发生反应的化学方程式: 。
过滤时用到玻璃棒,玻璃棒的作用是 。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
查看答案和解析>>
科目: 来源: 题型:探究题
(6分)
做完酸、碱、盐相关性质实验后,某实验小组不小心把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合在一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】猜想① Na2SO4、Na2CO3 猜想② Na2SO4、Na2CO3、NaOH
猜想③ Na2SO4、H2SO4、Na2CO3 猜想④ Na2SO4、 H2SO4
猜想⑤ Na2SO4
上述猜想中,你认为不合理的是猜想 (填序号)。
【实验探究】(1)甲同学取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是 (填“合理”或“不合理”)的,理由是 。
(2)乙同学向盛有一根生锈的铁钉的试管中加入适量该溶液,过一会儿取出铁钉,用水洗净,观察到铁锈消失,铁钉变得光亮,溶液变黄。该反应的化学方程式是 。
【实验结论】根据上述实验探究,你认为猜想 (填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是 (答一点即可)。
查看答案和解析>>
科目: 来源: 题型:探究题
有一种神奇的蜡烛,点燃后任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,
到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究。
【查阅资料】普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末。打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只
有150℃。当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧? ,这种蜡烛也可以熄灭,你采用的方法是 。
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | |
| 2 | | | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加硫酸铜溶液。 | 有红色物质析出 | 该金属一定是镁 |
| 操作步骤 | 现象 | 结论 |
| | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com