
科目: 来源: 题型:
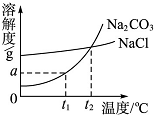 我国某地区有一种“冬天捞碱,夏天晒盐”的说法,这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量NaCl.某化学课外活动小组为了解释捞碱、晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究.
我国某地区有一种“冬天捞碱,夏天晒盐”的说法,这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中含有少量NaCl.某化学课外活动小组为了解释捞碱、晒盐的原理和测定“碱”样品中Na2CO3的含量进行了以下探究.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com