
科目: 来源:不详 题型:实验题
 。
。 们将两种反应后的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。写出产生浑浊现象的化学方程式: 。
们将两种反应后的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。写出产生浑浊现象的化学方程式: 。
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量溶液于试管中, | | 猜想 正确 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
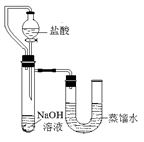
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题
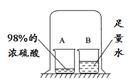
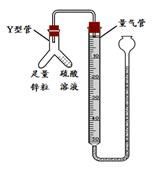
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 序号 | 实验内容 | 实验现象 | 实验结论 |
| ① | 取少量样品于烧杯中,滴加稀盐酸 | 有大量气泡生成 | 本格不填 |
| ② | 用铂丝蘸取①中溶液,在酒精灯上灼烧 | 火焰为砖红色 | 溶液中含有钙离子 |
| ③ | 另取少量样品于烧杯中,加水充分溶解,滴加 | 无蓝色出现 | 样品中不含有淀粉 |
| ④ | 另取少量样品于烧杯中,加水溶解,静置、过滤,在滤液中加入适量浓硝酸,加热至沸 | __ | 样品中含蛋白粉 (氨基酸) |
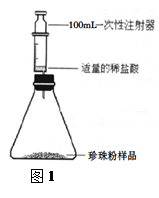
查看答案和解析>>
科目: 来源:不详 题型:实验题

| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 |

查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | |
| 2 | | | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加硫酸铜溶液。 | 有红色物质析出 | 该金属一定是镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com