
科目: 来源:不详 题型:实验题
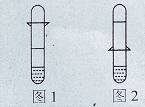
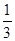 体积的NaOH溶液,发现塑料瓶变瘪。小敏宣布验证了CO2与NaOH发生了反应。
体积的NaOH溶液,发现塑料瓶变瘪。小敏宣布验证了CO2与NaOH发生了反应。查看答案和解析>>
科目: 来源:不详 题型:实验题
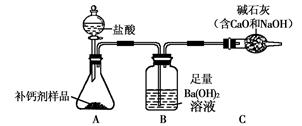
查看答案和解析>>
科目: 来源:不详 题型:实验题
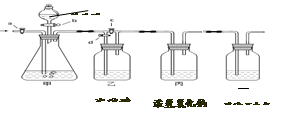
查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验 方案 | 实验操作 | 实验现象 | 结论 |
| 方案l | 取少量白色物质于试管中,加入适量水,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成 色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向溶液中加入过量的CaCl2溶液 | 出现白色 沉淀 | 白色物质 是_______ ___ |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 溶液显红色 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
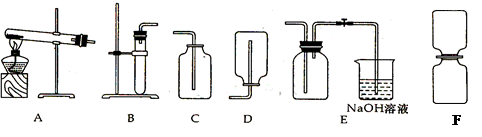
查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题

 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。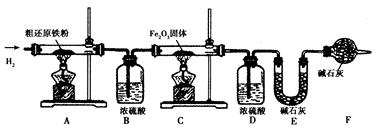
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。查看答案和解析>>
科目: 来源:不详 题型:实验题
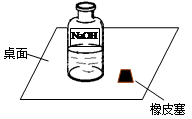
| 方 案 | 现 象 | 结 论 | |
| I | 取少量溶液于试管中,滴入足量__________试剂 | 产生大量气泡 | 猜想①不成立 |
| II | 取少量溶液于试管中,滴加酚酞试剂 | 溶液变红 | 溶液中一定含NaOH |
| III | a.取少量溶液于试管中,滴加足量________试剂; | ____________ | 猜想②成立 |
| b.向a中所得溶液中滴加酚酞 | 溶液变红 | ||
查看答案和解析>>
科目: 来源:不详 题型:问答题
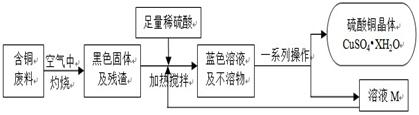

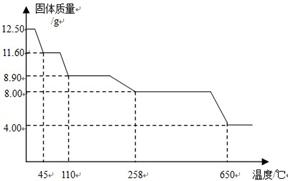
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com